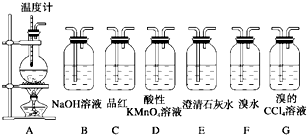
题目内容
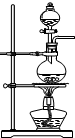
实验室用浓硫酸和乙醇混合加热制取乙烯,常因温度过高而发生副反应生成一定量的二氧化硫.请用下图装置设计一个实验,验证上述反应所得混合气体中含有乙烯和二氧化硫,并回答:(1)实验仪器a的名称是
(2)制备乙烯的化学方程式为:CH3CH2OH
| 浓硫酸 | 170℃ |
(3)装置的连接顺序为(用编号按气流从左到右表示)
A.NaOH溶液 B.浓硫酸 C.酸性KMnO4溶液 D.溴水
(4)能说明SO2气体存在的现象是
(5)能验证原混合气体中含有乙烯的现象是
分析:(1)根据仪器的构造解答仪器a的名称;
(2)乙醇在浓硫酸作用下加热到170℃生成乙烯和水,据此写出反应的化学方程式;
(3)按照先制取气体,然后检验二氧化硫、除去二氧化硫、检验二氧化硫除尽,最后检验乙烯的顺序进行解答;
(4)装置A中平衡褪色,证明二氧化硫存在;装置B中的氢氧化钠溶液吸收二氧化硫,防止干扰乙烯的检验;
(5)装置C中平衡不褪色,而装置D中酸性高锰酸钾溶液褪色,则证明混合气体中含有乙烯.
(2)乙醇在浓硫酸作用下加热到170℃生成乙烯和水,据此写出反应的化学方程式;
(3)按照先制取气体,然后检验二氧化硫、除去二氧化硫、检验二氧化硫除尽,最后检验乙烯的顺序进行解答;
(4)装置A中平衡褪色,证明二氧化硫存在;装置B中的氢氧化钠溶液吸收二氧化硫,防止干扰乙烯的检验;
(5)装置C中平衡不褪色,而装置D中酸性高锰酸钾溶液褪色,则证明混合气体中含有乙烯.
解答:解:(1)仪器a的名称为圆底烧瓶,故答案为:圆底烧瓶;
(2)乙醇发生消去反应生成乙烯的方程式为CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH2=CH2↑+H2O;
(3)由于SO2也能使溴水和酸性高锰酸钾溶液褪色,所以要首先检验SO2,利用的是①A品红溶液;为防止干扰乙烯的检验,还需要除去SO2,利用的试剂是①B氢氧化钠溶液同时为了避免SO2除不尽,还需要再次通过①C品红溶液来检验SO2是否完全被除尽,最后将气体通入到②D酸性高锰酸钾溶液来检验乙烯,所以装置的正确连接顺序为:③①②;D由于检验乙烯的存在,可以使用溴水或酸性高锰酸钾溶液,
故答案为:③①②;CD;
(4)二氧化硫检验漂白性,能够使品红褪色,若A中品红褪色,则能说明SO2气体存在;由于二氧化硫也具有还原性,会干扰乙烯的检验,所以使用氢氧化钠溶液除去二氧化硫,避免干扰检验乙烯,
故答案为:装置A中品红褪色;除去二氧化硫,避免干扰乙烯的检验;
(5)由于装置C品红不褪色,说明二氧化硫已经除尽,若D中仍然褪色,则证明混合气体中一定存在乙烯,
故答案为:C中品红不褪色、D中溶液褪色;装置C品红不褪色,说明二氧化硫除尽,D中褪色,证明一定存在乙烯.
(2)乙醇发生消去反应生成乙烯的方程式为CH3CH2OH
| 浓硫酸 |
| 170℃ |
(3)由于SO2也能使溴水和酸性高锰酸钾溶液褪色,所以要首先检验SO2,利用的是①A品红溶液;为防止干扰乙烯的检验,还需要除去SO2,利用的试剂是①B氢氧化钠溶液同时为了避免SO2除不尽,还需要再次通过①C品红溶液来检验SO2是否完全被除尽,最后将气体通入到②D酸性高锰酸钾溶液来检验乙烯,所以装置的正确连接顺序为:③①②;D由于检验乙烯的存在,可以使用溴水或酸性高锰酸钾溶液,
故答案为:③①②;CD;
(4)二氧化硫检验漂白性,能够使品红褪色,若A中品红褪色,则能说明SO2气体存在;由于二氧化硫也具有还原性,会干扰乙烯的检验,所以使用氢氧化钠溶液除去二氧化硫,避免干扰检验乙烯,
故答案为:装置A中品红褪色;除去二氧化硫,避免干扰乙烯的检验;
(5)由于装置C品红不褪色,说明二氧化硫已经除尽,若D中仍然褪色,则证明混合气体中一定存在乙烯,
故答案为:C中品红不褪色、D中溶液褪色;装置C品红不褪色,说明二氧化硫除尽,D中褪色,证明一定存在乙烯.
点评:本题考查了乙醇的消去反应,题目难度中等,注意掌握乙醇的消去反应原理,(3)为易错点,明确检验乙烯、二氧化硫混合气体的方法.

练习册系列答案
相关题目
实验室用浓硫酸和乙醇反应制备乙烯,反应为:CH3─CH2OH
CH2=CH2↑+H2O
若温度过高或加热时间过长,制得的乙烯往往混有少量CO2、SO2、H2O(气体).请回答下列问题:
I、怎样除去乙烯中的CO2和SO2?
II、写出乙烯通入溴水中反应的化学方程式 该反应的反应类型为
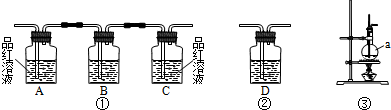
III、试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),
(1)按气流的方向,各装置的连接顺序是: .
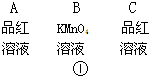
(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是 ,B瓶的作用是 ,C瓶的作用是 .
(3)装置②中所加的试剂名称是 ,它可以验证的气体是 ,
(4)装置③中所盛溶液的名称是 ,它可以用来验证的气体是 .
| 浓硫酸 |
| 170℃ |
若温度过高或加热时间过长,制得的乙烯往往混有少量CO2、SO2、H2O(气体).请回答下列问题:
I、怎样除去乙烯中的CO2和SO2?
II、写出乙烯通入溴水中反应的化学方程式
III、试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),
(1)按气流的方向,各装置的连接顺序是:
  |
② |
③ |
 ④ ④ |
(3)装置②中所加的试剂名称是
(4)装置③中所盛溶液的名称是
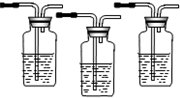
实验室可用乙醇来制取乙烯,工业上可用乙醇来制取乙醛.实验室用浓硫酸和乙醇制乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.请从图1中选用所需要的仪器(可重复选用)组成一套能进行上述反应,并检出所得混合气体中含有乙烯、SO2、CO2、H2O(g)的装置(连接用的玻璃管、橡胶管等略去).供选用的试剂:浓硫酸、无水乙醇、无水硫酸铜、酸性KMnO4溶液、FeCl3溶液、溴水、品红溶液、澄清石灰水、NaOH溶液、浓盐酸.按仪器连接顺序从上到下将下表补充完整.

Ⅱ.用图2装置进行乙醇的催化氧化实验并制取乙醛(图中铁架台等装置已略去,粗黑线表示乳胶管).请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是 ;
(2)乙中发生的反应的化学方程式为 ;
(3)若鼓气速度过快则会 ;
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、 接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在 中,检验乙醇催化氧化产物的试剂是 ,其化学方程式为 .

| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ① | B | 浓硫酸、无水乙醇 | 反应器 |
| ② | 无水硫酸铜 | 检出水蒸气 | |
| ③ | C | 品红溶液 | |
| ④ | C | 吸收SO2 | |
| ⑤ | C | 品红溶液 | |
| ⑥ | C | 检出乙烯 | |
| ⑦ | C | 澄清石灰水 | 检出CO2 |
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)乙中发生的反应的化学方程式为
(3)若鼓气速度过快则会
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接