题目内容
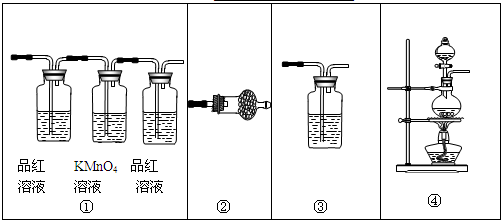
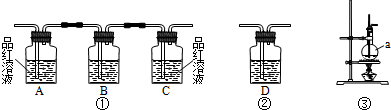
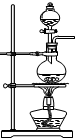
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.某课外小组设计了如下装置,证明乙烯中混有CO2、SO2并验证乙烯的性质.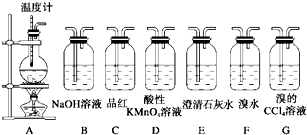
回答下列问题:
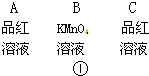
(1)装置A是乙烯的发生装置,图中一处明显的错误是
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水无明显变化、D后面的石灰水变混浊.请对出现该现象的原因进行合理猜想:
(4)若要一次性将三种气体全部检验出来,被检验的先后顺序是
分析:(1)温度计的位置取决于所测量的物质;乙醇沸点低,加热容易产生爆沸;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
依据乙烯不与氢氧化钠反应,二氧化硫能与氢氧化钠反应,乙烯具有还原性,能使酸性高锰酸钾褪色解答;
依据乙烯具有还原性能使溴的四氯化碳褪色,二氧化硫不与溴的四氯化碳反应的性质解答;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,结合乙烯的结构特点分析解答;
(4)依据只有乙烯能使溴的四氯化碳褪色,只有二氧化硫具有漂白性能够使品红溶液褪色,二氧化碳能够使澄清石灰水变浑浊的性质分析解答.
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
依据乙烯不与氢氧化钠反应,二氧化硫能与氢氧化钠反应,乙烯具有还原性,能使酸性高锰酸钾褪色解答;
依据乙烯具有还原性能使溴的四氯化碳褪色,二氧化硫不与溴的四氯化碳反应的性质解答;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,结合乙烯的结构特点分析解答;
(4)依据只有乙烯能使溴的四氯化碳褪色,只有二氧化硫具有漂白性能够使品红溶液褪色,二氧化碳能够使澄清石灰水变浑浊的性质分析解答.
解答:解:(1)浓硫酸和乙醇制取乙烯时,应严格控制反应物乙醇浓硫酸混合液的温度在170度,所以温度计测量的是混合液的稳定,温度计水银球部分没有插入液面以下;乙醇沸点低,加热时容易发生爆沸,加热碎瓷片可以防止爆沸,
故答案为:温度计水银球部分没有插入液面以下; 防止混合液在沸腾时剧烈跳动(暴沸);
(2)若A中所得气体含有SO2,则通到盛有品红溶液的C中,可以使品红溶液褪色;
将混合气体先通入B,用氢氧化钠吸收生成的二氧化硫,然后通入盛有酸性的高锰酸钾的D装置,若高锰酸钾褪色则可证明乙烯的存在;
乙烯具有还原性能使溴的四氯化碳褪色,干燥的二氧化硫不与溴的四氯化碳反应,将干燥的混合气体直接通入盛有溴的四氯化碳的G中,如果溶液褪色,则证明存在乙烯;
故答案为:C;D;G;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,而乙烯含有不饱和键具有还原性,能被高锰酸钾氧化,
故答案为:乙烯被酸性KMnO4溶液氧化成CO2;
(4)若要一次性将三种气体全部检验出来,可以将混合气体干燥后通入盛有溴的四氯化碳的洗气瓶,若洗气瓶褪色,则证明乙烯存在;然后通入品红溶液,若品红褪色,则证明二氧化硫存在;二氧化硫、二氧化碳都能使澄清石灰水变浑浊,所以应先利用酸性的高锰酸钾除去二氧化硫,然后通入澄清石灰水,若石灰石变浑浊,则证明存在二氧化碳,
故答案为:乙烯;二氧化硫;二氧化碳.
故答案为:温度计水银球部分没有插入液面以下; 防止混合液在沸腾时剧烈跳动(暴沸);
(2)若A中所得气体含有SO2,则通到盛有品红溶液的C中,可以使品红溶液褪色;
将混合气体先通入B,用氢氧化钠吸收生成的二氧化硫,然后通入盛有酸性的高锰酸钾的D装置,若高锰酸钾褪色则可证明乙烯的存在;
乙烯具有还原性能使溴的四氯化碳褪色,干燥的二氧化硫不与溴的四氯化碳反应,将干燥的混合气体直接通入盛有溴的四氯化碳的G中,如果溶液褪色,则证明存在乙烯;
故答案为:C;D;G;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,而乙烯含有不饱和键具有还原性,能被高锰酸钾氧化,
故答案为:乙烯被酸性KMnO4溶液氧化成CO2;
(4)若要一次性将三种气体全部检验出来,可以将混合气体干燥后通入盛有溴的四氯化碳的洗气瓶,若洗气瓶褪色,则证明乙烯存在;然后通入品红溶液,若品红褪色,则证明二氧化硫存在;二氧化硫、二氧化碳都能使澄清石灰水变浑浊,所以应先利用酸性的高锰酸钾除去二氧化硫,然后通入澄清石灰水,若石灰石变浑浊,则证明存在二氧化碳,
故答案为:乙烯;二氧化硫;二氧化碳.
点评:本题考查了乙醇脱水制备乙烯的实验,题目难度中等,侧重考查学生分析问题,设计实验的能力,熟练掌握各种气体的性质是本题解题的关键所在.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
实验室用浓硫酸和乙醇反应制备乙烯,反应为:CH3─CH2OH
CH2=CH2↑+H2O
若温度过高或加热时间过长,制得的乙烯往往混有少量CO2、SO2、H2O(气体).请回答下列问题:
I、怎样除去乙烯中的CO2和SO2?
II、写出乙烯通入溴水中反应的化学方程式 该反应的反应类型为
III、试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),
(1)按气流的方向,各装置的连接顺序是: .
(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是 ,B瓶的作用是 ,C瓶的作用是 .
(3)装置②中所加的试剂名称是 ,它可以验证的气体是 ,
(4)装置③中所盛溶液的名称是 ,它可以用来验证的气体是 .
| 浓硫酸 |
| 170℃ |
若温度过高或加热时间过长,制得的乙烯往往混有少量CO2、SO2、H2O(气体).请回答下列问题:
I、怎样除去乙烯中的CO2和SO2?
II、写出乙烯通入溴水中反应的化学方程式
III、试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),
(1)按气流的方向,各装置的连接顺序是:
  |
② |
③ |
 ④ ④ |
(3)装置②中所加的试剂名称是
(4)装置③中所盛溶液的名称是
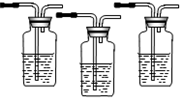
实验室可用乙醇来制取乙烯,工业上可用乙醇来制取乙醛.实验室用浓硫酸和乙醇制乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.请从图1中选用所需要的仪器(可重复选用)组成一套能进行上述反应,并检出所得混合气体中含有乙烯、SO2、CO2、H2O(g)的装置(连接用的玻璃管、橡胶管等略去).供选用的试剂:浓硫酸、无水乙醇、无水硫酸铜、酸性KMnO4溶液、FeCl3溶液、溴水、品红溶液、澄清石灰水、NaOH溶液、浓盐酸.按仪器连接顺序从上到下将下表补充完整.

Ⅱ.用图2装置进行乙醇的催化氧化实验并制取乙醛(图中铁架台等装置已略去,粗黑线表示乳胶管).请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是 ;
(2)乙中发生的反应的化学方程式为 ;
(3)若鼓气速度过快则会 ;
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、 接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在 中,检验乙醇催化氧化产物的试剂是 ,其化学方程式为 .

| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ① | B | 浓硫酸、无水乙醇 | 反应器 |
| ② | 无水硫酸铜 | 检出水蒸气 | |
| ③ | C | 品红溶液 | |
| ④ | C | 吸收SO2 | |
| ⑤ | C | 品红溶液 | |
| ⑥ | C | 检出乙烯 | |
| ⑦ | C | 澄清石灰水 | 检出CO2 |
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)乙中发生的反应的化学方程式为
(3)若鼓气速度过快则会
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接