题目内容
实验室可用乙醇来制取乙烯,工业上可用乙醇来制取乙醛.实验室用浓硫酸和乙醇制乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.请从图1中选用所需要的仪器(可重复选用)组成一套能进行上述反应,并检出所得混合气体中含有乙烯、SO2、CO2、H2O(g)的装置(连接用的玻璃管、橡胶管等略去).供选用的试剂:浓硫酸、无水乙醇、无水硫酸铜、酸性KMnO4溶液、FeCl3溶液、溴水、品红溶液、澄清石灰水、NaOH溶液、浓盐酸.按仪器连接顺序从上到下将下表补充完整.
| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ① | B | 浓硫酸、无水乙醇 | 反应器 |
| ② | 无水硫酸铜 | 检出水蒸气 | |
| ③ | C | 品红溶液 | |
| ④ | C | 吸收SO2 | |
| ⑤ | C | 品红溶液 | |
| ⑥ | C | 检出乙烯 | |
| ⑦ | C | 澄清石灰水 | 检出CO2 |
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)乙中发生的反应的化学方程式为
(3)若鼓气速度过快则会
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接
分析:Ⅰ.检验乙烯用溴水、检验二氧化硫用品红溶液,检验二氧化碳用澄清的石灰水,检验水蒸气用无水硫酸铜,因溶液中有水,所以先检验水蒸气,因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验先用品红溶液检验二氧化硫,然后检验二氧化碳,因为KMnO4溶液能与乙烯反应,所以检验二氧化碳之前用FeCl3溶液除尽SO2,并用品红溶液检验是否除尽;然后用溴水检验乙烯;最后通过澄清石灰水确认CO2存在;
Ⅱ.(1)加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;
(2)乙醇催化氧化可以生成乙醛;
(3)鼓气速度过快将会带走过多的热量;
(4)安全瓶中的导管是“短进长出”;冷却物质常用冰水混合物来冷却;乙醇氧化为乙醛,依据醛基检验方法进行设计实验,可以利用新制的氢氧化铜加热检验.
Ⅱ.(1)加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;
(2)乙醇催化氧化可以生成乙醛;
(3)鼓气速度过快将会带走过多的热量;
(4)安全瓶中的导管是“短进长出”;冷却物质常用冰水混合物来冷却;乙醇氧化为乙醛,依据醛基检验方法进行设计实验,可以利用新制的氢氧化铜加热检验.
解答:解:Ⅰ.因溶液中有水,所以先检验水蒸气,选用仪器A,因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验先用品红溶液检验二氧化硫,然后检验二氧化碳,因为KMnO4溶液能与乙烯反应,所以检验二氧化碳之前用FeCl3溶液除尽SO2,并用品红溶液检验是否除尽;然后用溴水检验乙烯;最后通过澄清石灰水确认CO2存在,
故答案为:
Ⅱ.(1)解:(1)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气,
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(2)乙醇发生催化氧化生成乙醛和水,方程式为:2CH3CH2OH+O2
2CH3CHO+H2O,
故答案为:2CH3CH2OH+O2
2CH3CHO+H2O;
(3)鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,
故答案为:鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度;
(4)为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以长导管有缓冲作用;
冷却物质一般常用冰水混合物来冷却;
乙醇氧化为乙醛,依据醛基检验方法进行设计实验,可以利用新制的氢氧化铜检验,化学方程式为:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O,
故答案为:b;a;冰水;新制的氢氧化铜;CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O.
故答案为:
| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ② | A | ||
| ③ | 检验SO2 | ||
| ④ | FeCl3溶液 | ||
| ⑤ | 检验SO2是否除尽 | ||
| ⑥ | 溴水 | ||
| ⑦ |
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(2)乙醇发生催化氧化生成乙醛和水,方程式为:2CH3CH2OH+O2
| 铜或银 |
| 加热 |
故答案为:2CH3CH2OH+O2
| 铜或银 |
| 加热 |
(3)鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,
故答案为:鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度;
(4)为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以长导管有缓冲作用;
冷却物质一般常用冰水混合物来冷却;
乙醇氧化为乙醛,依据醛基检验方法进行设计实验,可以利用新制的氢氧化铜检验,化学方程式为:CH3CHO+2Cu(OH)2
| △ |
故答案为:b;a;冰水;新制的氢氧化铜;CH3CHO+2Cu(OH)2
| △ |
点评:本题考查了物质性质的实验验证方法和实验设计,主要是乙烯、SO2、CO2、H2O(g)以及乙醇的催化氧化产物的检验,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
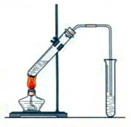 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.
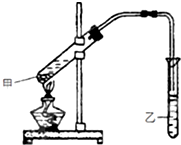 在试管甲中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管甲中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯. CH3COOC2H5+H2O
CH3COOC2H5+H2O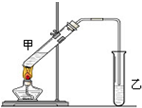 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: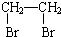
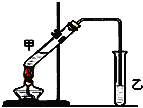 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: