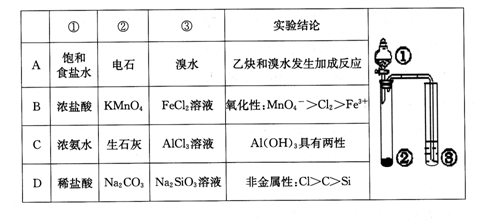
题目内容
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。.则下列说法不正确的是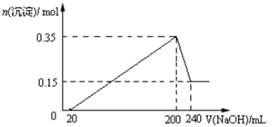
| A.镁和铝的总质量为9 g |
| B.最初20 mLNaOH溶液用于中和过量的硫酸 |
| C.硫酸的物质的量浓度为2.5 mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2 L |
D
解析试题分析:由图象可知,NaOH溶液0~20mL,发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;20~200mL发生的反应为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;200~240mL,发生的反应为:Al(OH)3+OH-=AlO2-+2H2O;当NaOH溶液200mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)=1/2n(NaOH);所以n(Na2SO4)=1/2×0.2L×5mol/L=0.5mol,所以硫酸的浓度为2.5mol/L;当NaOH溶液240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g;根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L。
考点:考查镁、铝的计算。

下列有关物质用途的说法中,正确的是
| A.氨气是生产硝酸的重要原料 | B.甲烷与氯气反应可制得纯净的一氯甲烷 |
| C.铁制容器可用来盛放稀硝酸 | D.油脂经皂化反应可获得高级脂肪酸 |
将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
| A.反应过程中得到6.72L的气体(标准状况下) |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8g的沉淀 |
| D.最终得到的溶液中c(NaCl)=1.6 mol/L |
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是 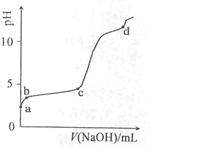
| A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为: Al3++3OH-  Al(OH)3 Al(OH)3 |
| B.a→b段,溶液pH增大,Al3+浓度不变 |
| C.b→c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
下列物质的转化在给定条件下不能实现的是
A.Ca(ClO)2(aq)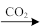 HClO(aq) HClO(aq) HCl(aq) HCl(aq) |
B.H2SiO3 SiO2 SiO2 SiCl4 SiCl4 |
C.Al2O3 NaAlO2(aq) NaAlO2(aq)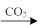 Al(OH)3 Al(OH)3 |
D.Fe2O3 Fe2(SO4)3(aq) Fe2(SO4)3(aq) 无水Fe2(SO4)3 无水Fe2(SO4)3 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
| A.加入KSCN溶液一定不变红色 | B.溶液中一定含Cu2+ |
| C.溶液中一定含Fe2+ | D.剩余固体中一定含铜 |