题目内容
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的
是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
(2)氯化铝水溶液呈 性 ,其离子方程式表示为 ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(1)A
(2)酸 Al3+ +3H2O Al(OH)3+3H+ Al2O3
Al(OH)3+3H+ Al2O3
(2)酸 Al3+ +3H2O
 Al(OH)3+3H+ Al2O3
Al(OH)3+3H+ Al2O3 试题分析:(1)①主要应用是温度对水解程度的影响;②发生反应
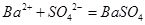
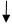 ,应用了沉淀溶解平衡原理;③应用了沉淀溶解平衡原理;④原因是,BaCO3能溶于胃酸产生有毒的钡离子,而BaSO4则不可以,应用了沉淀溶解平衡;⑤应用的是“降低温度至着火点以下、隔绝空气”等灭火原理。因此答案选A②③④。
,应用了沉淀溶解平衡原理;③应用了沉淀溶解平衡原理;④原因是,BaCO3能溶于胃酸产生有毒的钡离子,而BaSO4则不可以,应用了沉淀溶解平衡;⑤应用的是“降低温度至着火点以下、隔绝空气”等灭火原理。因此答案选A②③④。(2)氯化铝为强酸弱碱盐,其水溶液显酸性。原因为弱碱阳离子的水解:Al3++3H2O
 Al(OH)3+3H+。把AlCl3溶液蒸干,由于铝离子的水解,HCl挥发,最终的到的物质为Al(OH)3,再对其灼烧,则发生反应:
Al(OH)3+3H+。把AlCl3溶液蒸干,由于铝离子的水解,HCl挥发,最终的到的物质为Al(OH)3,再对其灼烧,则发生反应: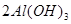

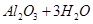 。因此最终得到的物质应为
。因此最终得到的物质应为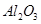 。
。点评:本题考查了沉淀的溶解平衡以及弱离子的水解,属于基础内容,也是高考必考考点。复习备考过程中应熟记中学阶段常见的弱酸弱碱,避免出现不知哪种离子发生水解的情况。

练习册系列答案
相关题目
 CH3COO-+H2O
CH3COO-+H2O