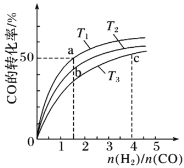
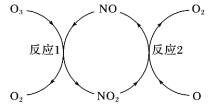
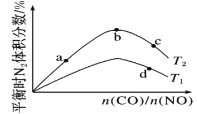
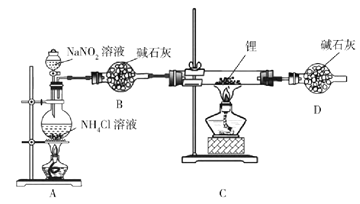
题目内容
【题目】设阿伏加德罗常数的值为NA。有关化工原料苯乙炔![]() 的下列叙述正确的是
的下列叙述正确的是
A.51 g该物质中含有单键数目为2NAB.标准状况下,22.4 L苯乙炔最多消耗2NA个HCl
C.1mol苯乙炔分子中共线的原子数最多为6NAD.苯乙炔与足量H2加成产物的一氯代物有5种
【答案】C
【解析】
A.苯环中没有碳碳双键,也没有碳碳单键,而苯乙炔![]() 中含有的单键有1个C-C单键,6个C-H单键,51 g苯乙炔的物质的量为
中含有的单键有1个C-C单键,6个C-H单键,51 g苯乙炔的物质的量为![]() =0.5mol,含有C-C单键0.5mol,含有C-H单键0.5mol×6=3mol,数目为3.5NA,故A错误;
=0.5mol,含有C-C单键0.5mol,含有C-H单键0.5mol×6=3mol,数目为3.5NA,故A错误;
B.苯乙炔在标准状况下不是气体,无法计算22.4 L苯乙炔的物质的量,也就无法计算最多消耗的HCl数目,故B错误;
C.苯环是正六边形结构,乙炔是直线结构,苯乙炔分子中共线的原子有6个,因此1mol苯乙炔分子中共线的原子数最多为6NA,故C正确;
D.苯乙炔与足量H2加成产物的结构简式为![]() ,分子中含有6种H原子,一氯代物有6种,故D错误;
,分子中含有6种H原子,一氯代物有6种,故D错误;
故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L