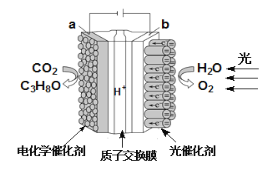
题目内容
【题目】在指定条件下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙试剂显红色的溶液中:Na、Fe2、Cl-、NO3-
B.滴入KSCN显血红色的溶液中:NH4、Al3、NO3-、SO42-
C.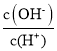 =1012的溶液中:NH4+、K+、Cl-、HCO3-
=1012的溶液中:NH4+、K+、Cl-、HCO3-
D.由水电离的c(H+)=1.0×l0-13mol/L溶液中:K、Al3、SO42-、CH3COO-
【答案】B
【解析】
A.滴加甲基橙试剂溶液显红色说明溶液显酸性,酸性溶液中硝酸根有强氧化性,会与亚铁离子发生氧化还原反应,所以不能大量共存,故A错误;
B.滴入KSCN显血红色的溶液中含有铁离子,铁离子与NH4、Al3、NO3-、SO42-均不反应,所以可以大量共存,故B正确;
C. =1012的溶液为碱性溶液,NH4+、HCO3-在碱性溶液中不能大量存在,故C错误;
=1012的溶液为碱性溶液,NH4+、HCO3-在碱性溶液中不能大量存在,故C错误;
D.由水电离的c(H+)=1.0×l0-13mol/L溶液可能为酸性溶液,也可能为碱性溶液,若为酸性溶液,CH3COO-不能大量存在,若为碱性溶液,Al3不能大量存在,故D错误;
综上所述,答案为B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
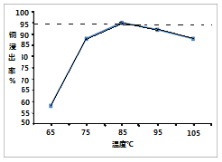
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。
(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。
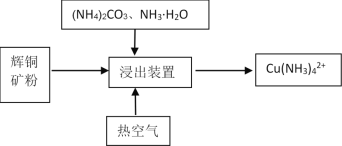
其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。