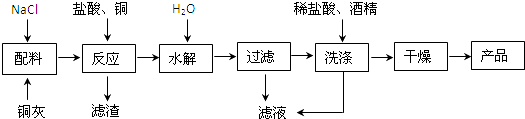
��Ŀ����
����Ŀ��ClO2��Cl2�������������������ˮ�����ȷ���Ӧ�ù㷺����֪ClO2�ڳ�������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�棬�е�Ϊ11.0�棬������ˮ��ijѧ��ͨ��ͼ1��ʾװ�ö�ClO2������ģ�ҵ�Ʊ����ռ������ա��ͷź�Ӧ�õ��о��� 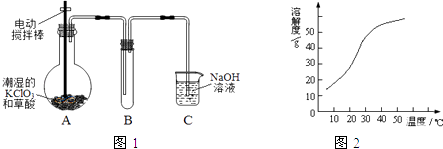
��1��װ��A���Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ����K2CO3��ClO2��CO2 �� �÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ �� ��Ӧװ��A�еIJ����������ƾ��ơ��ձ��⣬����Ҫ ��
��2��װ��B������ڱ�ˮԡ�У���ԭ���� ��
��3����Ӧ����װ��C�пɵ�NaClO2��Һ����֪��1��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O�����¶ȸ���38��ʱ�����ľ�����NaClO2 �� �¶ȸ���60��ʱNaClO2��ֽ�����NaClO3��NaCl����2��NaClO2���ܽ��������ͼ2��ʾ���벹���NaClO2��Һ���Ƶ�NaClO2�����ʵ��������裺
�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ����������õ���Ʒ��
��4����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� �÷�Ӧ�����ӷ���ʽΪ ��
��5����ClO2������������ˮ�Ậ��һ�������������Σ���Ҫ��ȥ������������Σ��������������˵���������ţ��� a������ b���⻯�� c������ d������������
���𰸡�
��1��2��1���¶ȼ�
��2��ʹClO2������������ٻӷ�
��3����38�桫60����ˮϴ�ӣ�����60�����
��4��5ClO2��+4H+�TCl��+4ClO2��+2H2O
��5��d
���������⣺��1.��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4 �� ��Ӧ�ķ���ʽΪ2KClO3+H2C2O4+2H2SO4 ![]() 2ClO2��+2CO2��+2KHSO4+2H2O��������ΪKClO3 �� ��ԭ��ΪH2C2O4 �� �������ʵ���֮��Ϊ2��1��װ��A���Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ����K2CO3��ClO2��CO2 �� ��Ӧװ��A�еIJ����������ƾ��ơ��ձ��⣬����Ҫ��֪��Ӧ���¶ȣ���Ҫ�¶ȼƣ�
2ClO2��+2CO2��+2KHSO4+2H2O��������ΪKClO3 �� ��ԭ��ΪH2C2O4 �� �������ʵ���֮��Ϊ2��1��װ��A���Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ����K2CO3��ClO2��CO2 �� ��Ӧװ��A�еIJ����������ƾ��ơ��ձ��⣬����Ҫ��֪��Ӧ���¶ȣ���Ҫ�¶ȼƣ�
���Դ��ǣ�2��1���¶ȼƣ�
��2.���������ȵ��۵�ϵͣ�Ϊ�ռ��������ȣ�Ӧ�ڽϵ��¶��½��У�����Ӧ�ò��ñ�ˮԡ�����Դ��ǣ�ʹClO2������������ٻӷ���
��3.������Һ����ȡ���ʣ�һ����������ᾧ�����ˡ�ϴ�ӡ�����ķ�����Ϊ��ֹ��������NaClO23H2O�����Դ��ǣ���38�桫60����ˮϴ�ӣ�����60����
��4.��������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� ����Ԫ���غ��֪Ӧ����ˮ���ɣ��÷�Ӧ�����ӷ���ʽΪ��4H++5ClO2��=Cl��+4ClO2��+2H2O�����Դ��ǣ�5ClO2��+4H+�TCl��+4ClO2��+2H2O��
��5.����Ҫ��ȥ������������Σ�ac�����ܻ�ԭ�������Σ�b��KI���л�ԭ�Ե��������ﲻ�ʺ�����ˮʹ�ã�ֻ��d��Fe2+��ClO2����ԭ��Cl�� �� Fe2+ ������Ϊ�����ӣ���������ˮ�����ɽ���ɾ�������ˮ���������˵���d�����Դ��ǣ�d��