题目内容
【题目】CuCl为白色晶体,微溶于水,不溶于稀酸和醇,易水解,在空气中易氧化成Cu2(OH)3Cl.实验室以铜灰(主要成分为CuO,其含量约为70%)制备CuCl的流程如下: 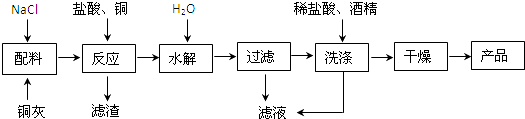
制备流程中,“水解”中发生的反应为:Na[CuCl2]=CuCl↓+NaCl.
(1)“反应”中,发生的化学方程式为 , 加入稍过量的盐酸作用有、 .
(2)“洗涤”中,先用稀盐酸洗涤数次后用酒精漂洗,用酒精漂洗的目的是 .
(3)“过滤”、“洗涤”和“干燥”都必须在真空密闭的环境中进行,否则会发生反应的化学方程式为 .
(4)流程工艺中,水解后的滤液经过后期处理,可回收(填化学式)以循环使用.
【答案】
(1)CuO+2HCl+2NaCl+Cu═2Na[CuCl2]+H2O;使反应充分进行或提高铜元素的浸取率;抑制CuCl水解
(2)洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥
(3)4CuCl+O2+4H2O═2Cu2(OH)3Cl+2HCl
(4)NaCl
【解析】解:铜灰(主要成分为CuO,其含量约为70%)中加入氯化钠再加盐酸和铜发生反应生成Na[CuCl2],过滤除去滤渣,滤液进行水解得氯化亚铜,过滤,CuCl为在空气中易氧化成Cu2(OH)3Cl,所以所得固体用盐酸洗涤以除去Cu2(OH)3Cl,再酒精洗涤干燥得CuCl.
(1.)“反应”中铜、氯化钠、盐酸、氧化铜反应生成氯化亚铜,反应的方程式为CuO+2HCl+2NaCl+Cu═2Na[CuCl2]+H2O,CuCl能 水解,所以加入稍过量的盐酸抑制其水解,同时能提高铜元素的浸取率,所以答案是:CuO+2HCl+2NaCl+Cu═2Na[CuCl2]+H2O;使反应充分进行或提高铜元素的浸取率、抑制CuCl水解;
(2.)CuCl难溶于酒精,且酒精易挥发,所以用酒精漂洗的目的是洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥,所以答案是:洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥;
(3.)CuCl在空气中易氧化成Cu2(OH)3Cl,反应的方程式为4CuCl+O2+4H2O═2Cu2(OH)3Cl+2HCl,所以答案是:4CuCl+O2+4H2O═2Cu2(OH)3Cl+2HCl;
(4.)根据信息Na[CuCl2]=CuCl↓+NaCl,水解后的滤液中含有氯化钠,可以循环使用,
所以答案是:NaCl.

 阅读快车系列答案
阅读快车系列答案