题目内容
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是: (3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
(1)抑制Sn2+水解, 防止Sn2+被氧化 (2)SnCl2 + Na2CO3 =" SnO" + CO2↑+2NaCl(3)取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净(3分)(4)小于1 (2分。若写成≤1给1分) (5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O (6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
解析试题分析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑;(3)检验沉淀已经“漂洗”干净的方法是:取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净;(4)根据 Ksp[Sn(OH)2]=1.0×10-26=c(OH-)2×c(Sn2+),将c(Sn2+)=1.0mol?L-1带人可得c(OH-)=10-13mol/L,c(H+)=0.1mol/L,故PH小于1,Sn2+完全沉淀;(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O;(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化。
考点:物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol
 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
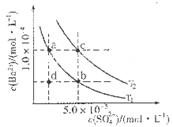
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) | B.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D.c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
② 若为HCl 和NH4Cl 混合溶液,则四种离子浓度的由大到小的顺序是_________;
若为NH3· H2O 和NH4Cl 混合溶液,四种离子浓度的由大到小的顺序是__________。
③ 若该溶液是由体积相等的HCl溶液和氨水混合而成,且恰好呈中性,则混合前c(HCl) _____c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(OH-)____c(NH4+)。
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
 H++B2-。回答下列问题。
H++B2-。回答下列问题。
 H++OH? ,请回答:
H++OH? ,请回答: H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。