题目内容
1.下列叙述正确的是( )| A. | 两种难溶性盐,Ksp较小的,其溶解度也一定较小 | |
| B. | 稀释氨水溶液,溶液中所有离子的浓度都降低 | |
| C. | 稀释醋酸钠溶液,CH3COO-水解程度变大,故溶液的pH增大 | |
| D. | 相同条件下,HA比HB易电离,则NaA溶液的pH比NaB溶液的pH小 |
分析 A.只有相同类型的难溶电解质,Ksp越小,溶解度可能会小;
B.稀释氨水的过程中,氢氧根离子浓度减小,而水的离子积不变,氢离子浓度增大;
C.稀释促进水解,离子浓度减小;
D.相同条件下,一元酸HA比HB易电离,说明HA的酸性大于HB,则水解程度B->A-,水解程度越大相同浓度的钠盐,其溶液的pH越大.
解答 解:A.只有相同类型的难溶电解质,Ksp越小,溶解度可能会小,不同类型的难溶电解质,不能根据Ksp判断溶解度的大小,故A错误;
B.稀释氨水,溶液中氢氧根离子浓度减小,温度不变,水的离子积不变,所以溶液中氢离子浓度增大,故B错误;
C.CH3COONa溶液存在水解平衡:CH3COO-+H2O?CH3COOH+OH-.稀释溶液,平衡正向进行,平衡状态下氢氧根离子浓度减小,溶液的pH减小,故C错误;
D.相同条件下,一元酸HA比HB易电离,说明HA的酸性大于HB,则水解程度B->A-,水解程度越大相同浓度的钠盐,其溶液的pH越大,所以相同浓度NaA溶液比NaB溶液的pH小,故D正确.
故选D.
点评 本题考查了水解平衡和电离平衡的影响因素分析判断,明确Ksp比较沉淀溶解性时,是同类型沉淀之间的比较,不同类型沉淀则需要定量计算,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
16. 如图是汽车尾气催化转化装置工作原理示意图:
如图是汽车尾气催化转化装置工作原理示意图:
下列说法不正确的是( )
 如图是汽车尾气催化转化装置工作原理示意图:
如图是汽车尾气催化转化装置工作原理示意图:下列说法不正确的是( )
| A. | 汽车尾气是雾霾成因之一,主要有CO、NO | |
| B. | 该过程中NO2既是生成物又是反应物 | |
| C. | 该过程中氧元素被还原,氮元素被氧化 | |
| D. | 该过程中会有反应:2NO2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2 |
17. 光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
 光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )| A. | n型半导体为负极 | |
| B. | X2为O2,H+由b极向a极移动 | |
| C. | b极的电极反应式为CO2+6e-+6H+=CH3OH+H2O | |
| D. | 当制备32g甲醇时,质子交换膜两侧溶液相差104g |
9.在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2mol A和1mol B,发生反应:2A(g)+B(g)?2D(g)△H=Q kJ•mol-1.相关条件和数据见下表:下列说法正确的是( )
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
| A. | K3>K2=K1 | |
| B. | 实验Ⅱ可能使用了催化剂 | |
| C. | 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的$\frac{9}{10}$倍 | |
| D. | 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动 |
16.山梨酸是应用广泛的防腐剂,其结构如图,下列关于山梨酸的说法错误的是( )
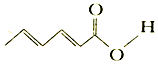

| A. | 分子式为C6H8O2 | |
| B. | 可使KMnO4(H+)溶液褪色 | |
| C. | 1 mol 该物质最多可与3 mol Br2 发生加成反应 | |
| D. | 可与醇发生取代反应 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 反应6NaBH4+2FeC13+18H2O=2Fe+6NaCl+6H3BO3+21H2↑可制纳米铁,该反应中每生成1 mol Fe,转移的电子数目为3NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧后生成的CO2分子数为NA | |
| C. | 1mol氯气与过量铁反应,转移的电子数为3NA | |
| D. | 30g甲酸甲酯与葡萄糖的混合物中含有的原子数为4NA |
13.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 向水中加人少量固体NaOH,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
