题目内容
(2009?湘潭一模)下列反应的离子方程式书写正确的是( )
分析:A、氧化还原反应中同种元素的化合价向中间靠拢,可以判断氯酸根离子中的+5价氯原子被还原成0价氯原子;
B、铵离子与亚硫酸氢根离子都与足量的氢氧根离子反应,加热条件下能够产生氨气;
C、氢离子部分过量,反应生成了氢氧化铝沉淀和铝离子;
D、反应生成了氢氧化铁胶体,不是氢氧化铁沉淀.
B、铵离子与亚硫酸氢根离子都与足量的氢氧根离子反应,加热条件下能够产生氨气;
C、氢离子部分过量,反应生成了氢氧化铝沉淀和铝离子;
D、反应生成了氢氧化铁胶体,不是氢氧化铁沉淀.
解答:解:A、用K37ClO3与浓盐酸制氯气:K37ClO3中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平,所以正确的离子方程式为:237ClO3-+12H++10Cl-=37Cl2↑+5Cl2 ↑+6H2O,故A错误;
B、NH4HSO3溶液与足量的NaOH溶液混合加热反应生成了氨气、亚硫酸根离子和水,反应的离子方程式为:NH4++HSO3-+2OH-
SO32-+NH3↑+2H2O,故B正确;
C、1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合,设溶液体积为1L,则溶液中含有1mol偏铝酸根离子、2.5mol氢离子,1mol偏铝酸根离子完全反应生成氢氧化铝消耗氢离子1mol;氢离子还剩余1.5mol,1.5mol氢离子能够溶液0.5mol氢氧化铝,反应后还剩余0.5mol氢氧化铝,所以反应的离子方程式为:2AlO2-+5H+═Al3++Al(OH)3↓+H2O,故C错误;
D、向沸水中滴入适量的饱和氯化铁溶液生成的是氢氧化铁胶体,反应的离子方程式为:Fe3++3H2O
Fe(OH)3(胶体)+3H+,故D错误;
故选B.
B、NH4HSO3溶液与足量的NaOH溶液混合加热反应生成了氨气、亚硫酸根离子和水,反应的离子方程式为:NH4++HSO3-+2OH-
| ||
C、1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合,设溶液体积为1L,则溶液中含有1mol偏铝酸根离子、2.5mol氢离子,1mol偏铝酸根离子完全反应生成氢氧化铝消耗氢离子1mol;氢离子还剩余1.5mol,1.5mol氢离子能够溶液0.5mol氢氧化铝,反应后还剩余0.5mol氢氧化铝,所以反应的离子方程式为:2AlO2-+5H+═Al3++Al(OH)3↓+H2O,故C错误;
D、向沸水中滴入适量的饱和氯化铁溶液生成的是氢氧化铁胶体,反应的离子方程式为:Fe3++3H2O
| ||
故选B.
点评:本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,侧重对学生能力的培养和训练,该题需要明确判断离子方程式常用方法(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);(5)检查是否符合原化学方程式,然后灵活运用即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
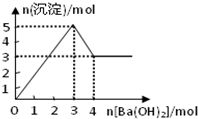 (2009?湘潭一模)如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
(2009?湘潭一模)如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
 (2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: