题目内容
 (2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:(1)写出OA段所发生反应的离子方程式
H++OH-═H2O
H++OH-═H2O
、CO32-+H+═HCO3-
CO32-+H+═HCO3-
.(2)当加入35mL盐酸时,产生CO2的体积为
224
224
mL(标准状况).(3)计算原混合物中NaOH的质量及碳酸钠的质量分数.
分析:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠.
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体;
(3)由三种物质消耗酸的体积及三种物质的总质量来计算.
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体;
(3)由三种物质消耗酸的体积及三种物质的总质量来计算.
解答:解:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段0~5mL先发生酸碱中和,
其离子反应方程式为H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35-25)×10-3L×1mol?L-1=0.01mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.01mol n
=
,解得n=0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224;
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
①x+y=1mol/L×(0.045-0.025)L
②x+z=1mol/L×0.025L
③84g/mol?x+106g/mol?y+40g/mol?z=2.5g
联立①②③式解得x=0.01mol,y=0.01mol,z=0.015mol
故NaOH的质量为0.015mol×40g/mol=0.6g,
Na2CO3的质量分数为
×100%=42.4%,
答:原混合物中NaOH的质量为0.6g,碳酸钠的质量分数为42.4%.
其离子反应方程式为H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35-25)×10-3L×1mol?L-1=0.01mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.01mol n
| 1 |
| 1 |
| 0.01mol |
| n |
故答案为:224;
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
①x+y=1mol/L×(0.045-0.025)L
②x+z=1mol/L×0.025L
③84g/mol?x+106g/mol?y+40g/mol?z=2.5g
联立①②③式解得x=0.01mol,y=0.01mol,z=0.015mol
故NaOH的质量为0.015mol×40g/mol=0.6g,
Na2CO3的质量分数为
| 0.01mol×106g/mol |
| 2.5g |
答:原混合物中NaOH的质量为0.6g,碳酸钠的质量分数为42.4%.
点评:本题考查学生利用图象和发生的离子反应来分析解答问题,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
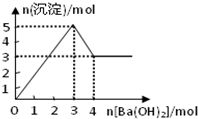 (2009?湘潭一模)如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
(2009?湘潭一模)如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )