题目内容
(2009?湘潭一模)如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞).
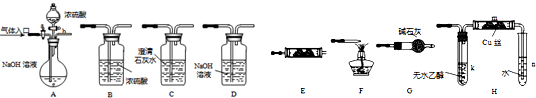
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇.此时,活塞a应
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质.
①装置A中能产生氨气的原因有:
②实验中观察到E内有红棕色气体出现,证明氨气具有

(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为
ACBECF
ACBECF
(填装置代号).能验证CO氧化产物的现象是AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
.(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇.此时,活塞a应
关闭
关闭
,活塞b应打开
打开
,需要加热的仪器装置有k、m
k、m
(填仪器代号),m中反应的化学方程式为2CH3CH2OH+O2
2CH3CHO+2H2O
| ||
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.
| ||
| △ |
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质.
①装置A中能产生氨气的原因有:
氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出
氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出
.②实验中观察到E内有红棕色气体出现,证明氨气具有
还原
还原
性.分析:(1)用NaOH溶液澄清石灰水除去CO2,用浓硫酸干燥CO,用CuO氧化CO,用澄清石灰水检验CO的氧化产物,燃烧法除去多余的CO;
(2)停止CO和CO2混合气体的通入,a应关闭,b打开,浓硫酸与NaOH溶液反应放出热量,加快A中的水的蒸发,H2O与E中Na2O2反应可生成O2,加热k有利于CH3CH2OH的挥发,加热m,CH3CH2OH与O2反应生成CH3CHO,
(3)①利用平衡移动以及氨气在溶液中的溶解度分析;
②NH3被O2氧化则证明氨气具有还原性.
(2)停止CO和CO2混合气体的通入,a应关闭,b打开,浓硫酸与NaOH溶液反应放出热量,加快A中的水的蒸发,H2O与E中Na2O2反应可生成O2,加热k有利于CH3CH2OH的挥发,加热m,CH3CH2OH与O2反应生成CH3CHO,
(3)①利用平衡移动以及氨气在溶液中的溶解度分析;
②NH3被O2氧化则证明氨气具有还原性.
解答:解:(1)要获得纯净干燥的CO就必须用A中的NaOH溶液吸收CO2,并通过C中的澄清石灰水不变浑证明CO2已被完全吸收,再通过B浓硫酸干燥CO气体.CO通过E中加热的CuO被氧化成CO2,被C中澄清石灰水吸收变浑浊,证明CO还原性及氧化产物.所选装置的连接顺序为ACBECF,
故答案为:ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊;
(2)停止CO和CO2混合气体的通入就要关闭活塞a,打开活塞b放入稀H2SO4与NaOH 发生中和反应,放热有水蒸气从A装置中出来,与E中Na2O2反应就会有O2生成,副产物NaOH进入D中,O2以B中浓H2SO4干燥再进入H装置将乙醇蒸气与O2能守加热的铜丝网被氧化成乙醛,反应的化学方程式为2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:关闭、打开;k、m;2CH3CH2OH+O2
2CH3CHO+2H2O;
(3)①利用平衡移动以及氨气在溶液中的溶解度分析,氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
故答案为:氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出;
②氨气通过G中碱石灰被干燥,在E中铂铑合金的催化作用下与O2反应,被氧化成NO,NO接触O2就会被氧化成红棕色的NO2气体.NH3被O2氧化则证明氨气具有还原性.故答案为:还原.
故答案为:ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊;
(2)停止CO和CO2混合气体的通入就要关闭活塞a,打开活塞b放入稀H2SO4与NaOH 发生中和反应,放热有水蒸气从A装置中出来,与E中Na2O2反应就会有O2生成,副产物NaOH进入D中,O2以B中浓H2SO4干燥再进入H装置将乙醇蒸气与O2能守加热的铜丝网被氧化成乙醛,反应的化学方程式为2CH3CH2OH+O2
| ||
| △ |
故答案为:关闭、打开;k、m;2CH3CH2OH+O2
| ||
| △ |
(3)①利用平衡移动以及氨气在溶液中的溶解度分析,氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
故答案为:氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出;
②氨气通过G中碱石灰被干燥,在E中铂铑合金的催化作用下与O2反应,被氧化成NO,NO接触O2就会被氧化成红棕色的NO2气体.NH3被O2氧化则证明氨气具有还原性.故答案为:还原.
点评:该综合实验题出法很有新意,有仅考查了气体的制备、分离、干燥和性质验证,还考查了教材中的多方面核心知识内容,如Na2O2的性质,乙醇的脱氢氧化反应,氨的催化氧化反应等,可以说考查的内容相当丰富.而且一套实验仪器用于多种实验这在高考题中也非常少见.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
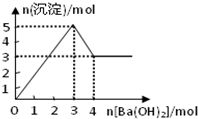 (2009?湘潭一模)如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
(2009?湘潭一模)如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( ) (2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: