题目内容
【题目】某溶液中含大量![]() 离子,其中加入足量的
离子,其中加入足量的![]() 固体后,再加入足量盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
固体后,再加入足量盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】B
【解析】
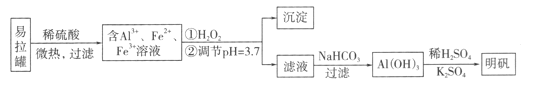
A.因为Na2O2是强氧化剂,而且遇水生成NaOH,钠离子数目增大,Fe2+氧化成Fe3+,Fe2+数目减少,故A错误;
B.Na2O2是强氧化剂,而且遇水生成NaOH,铝离子能和过量的氢氧化钠反应生成偏铝酸根离子,在盐酸作用下又会生成铝离子,根据铝元素守恒,则铝离子量不变,硫酸根离子自始至终不发生变化,故B正确;
C.因为Na2O2是强氧化剂,而且遇水生成NaOH,于是Fe2+氧化成Fe3+,并沉淀,再和盐酸反应生成三价铁离子,所以三价铁离子数目增大,故C错误;
D.加入足量的盐酸溶解沉淀,氯离子数目增大,故D错误;
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】根据下列实验现象,所得结论正确的是
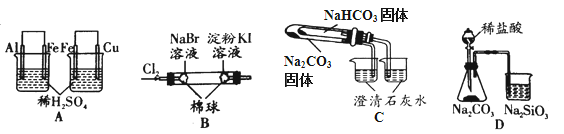
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D