题目内容
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:___________。
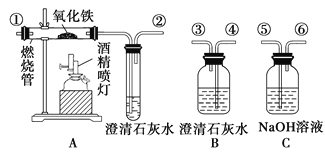
Ⅱ、利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、_______、______,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________。
(5)已知C中是硅酸钠溶液,如要证明非金属性:C > Si,请选择相应的试剂,则A中加________、B中加________。
【答案】 钾 铝 不合理 用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2= S↓+2Cl- 硫酸 Na2CO3 溶液
【解析】Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,在金属活动顺序中越排在前面的金属越活泼,与相同的酸反应的速率越快,所以与盐酸反应最快的金属是钾;在金属活动顺序中越排在后面的金属越不活泼,与相同的酸反应的速率越慢,所以与盐酸反应最慢的金属是铝; (2)用氢氧化钠和氨水碱性强弱比较Na和N的金属性强弱不合理,因为用碱性比较金属性强弱,必须要用最高价氧化物对应水化物的碱性强弱来比较,答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,氨水不是N元素的最高价氧化物对应水化物;Ⅱ、(3)设计实验证明非金属性:Cl>S,利用氯气和Na2S氧化还原反应可以验证,仪器A的名称为分液漏斗,干燥管D的作用是防止倒吸;(4)装置A、B、C中所装药品分别为浓盐酸、MnO2、Na2S溶液,装置C中的现象为有淡黄色沉淀生成,说明Cl2氧化Na2S生成了S,离子方程式为:S2-+Cl2=S↓+2Cl-;(4)若要证明非金属性:S>C>Si,则A中加浓硫酸,B中加Na2CO3,C中加Na2SiO3,硫酸和碳酸钠反应生成CO2,再将生成的CO2通入C中CO2、水和硅酸钠反应生成硅酸,反应的离子方程式为:CO2+H2O+SiO32-=H2SiO3+CO32-,证明酸性硫酸>碳酸>硅酸。