题目内容
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做l题。若两题都作答,则以A题计分。
A《化学与生活》
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是______(填字母)。
a.二氧化碳的浓度 b.二氧化硫的浓度 c.可吸入颗粒物的浓度
②下列做法中不利于改善环境质量的是______(填字母)。
a.将废旧电池进行深埋处理
b.充分利用风能等新能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是______(填字母)。
a.氧化还原法 b.中和法 c.沉淀法
④煤炭直接燃烧引起多种环境问题。燃煤产生的SO2增加了______形成的可能;处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为_____________________。
(2)合理应用化学知识可以更好地认识生活、改善生活。
①等质量的糖类、油脂、蛋白质中,提供能量最多的是______。蛋白质水解可以得到______。
②人体牙龈出血、患坏血病的原因主要是因为缺乏______(填“维生素A”、“维生素C”或“维生素D”)。
(3)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题:

①石墨烯(见图)可用作太阳能电池的电极,这里主要利用了石墨烯的______性。
②高炉炼铁和生产硅酸盐水泥都要用到的原料是______(填字母)。
a. 黏土 b. 石灰石 c. 焦炭
③“神七”国产“飞天”舱外服由六层组成。从内到外依次为由特殊防静电处理过的棉布组成的舒适层、合成橡胶质地的备份气密层、复合材料结构组成的主气密层、涤纶面料的限制层、隔热层和最外防护层。其中由天然有机高分子材料组成的层是______(填字母)。
a. 舒适层 b. 备份气密层 c. 主气密层
④材料与化学密切相关,表中对应关系正确的是______(填字母)。
选项 | 材料 | 主要化学成分 |
a | 刚玉、金刚石 | 三氧化二铝 |
b | 大理石、石灰石 | 碳酸钙 |
c | 光导纤维、普通玻璃 | 硅酸盐 |
⑤铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用盐酸除去,写出该反应的化学方程式________________________________。
B《有机化学基础》
(1)认识有机化合物的结构与类别有助于理解其性质。
①下列有机化合物与苯甲酸(C6H5COOH)互为同系物的是______(填字母,下同)。
a. C6H5CH2COOH b. C6H5CH2CHO c. C6H5OH
②下列有机化合物易溶于水的是______。
a. 苯 b. 乙烷 c. 乙醇
③下列试剂可用于鉴别乙酸和乙醛的是______。
a. 水 b. 银氨溶液 c. 稀硫酸
(2)扁桃酸(C6H5CHOHCOOH)是一种重要的化工原料。
①扁桃酸分子中有______种不同化学环境的氢。
②扁桃酸中含氧官能团的名称为______和______。
③1 mol扁桃酸最多能与______mol金属钠反应
(3)化合物C是一种医药中间体,可通过下列方法合成:
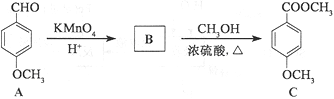
①A中含氧官能团的名称为______和______。
②B的结构简式为______。
③B→C的反应类型为______。
④C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应,且1molD最多能与2molNaOH反应。D分子中有4种不同化学环境的氢,请写出D的一种结构简式:______。
【答案】a a b (硫酸型)酸雨 2CO+SO2![]() 2CO2+S 油脂 氨基酸 维生素C 导电 b a b Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O a c b 6 羟基 羧基 2 醛基 醚键
2CO2+S 油脂 氨基酸 维生素C 导电 b a b Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O a c b 6 羟基 羧基 2 醛基 醚键 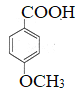 取代反应或酯化反应
取代反应或酯化反应 
【解析】
A《化学与生活》
(1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,二氧化碳的浓度不需要检测,故答案选a;
②a.废旧电池中含有重金属,进行深埋处理能污染水资源和土壤,应回收处理,故a错误;
b.充分利用太阳能等清洁能源,减少了化石燃料的使用,有利于改善环境质量,故b正确;
c.给汽车加装尾气催化净化装置,减少了污染物一氧化碳和一氧化氮的排放,有利于改善环境质量,故c正确;
故答案选a;
③废水中含有盐酸,盐酸易溶于水,盐酸溶液呈酸性,所以要在废水中加入碱性物质,使其发生酸碱中和反应而降低废水的酸性,所以采用的处理方法是中和法,故答案选b;
④二氧化硫容易引起酸雨,则燃煤产生的SO2增加了硫酸型酸雨形成的可能;处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,硫元素化合价降低,则碳元素化合价升高,因此还有二氧化碳生成,则发生反应的化学方程式为2CO+SO2![]() 2CO2+S。
2CO2+S。
(2)①每克脂肪在人体内氧化分解产生约为37.6kJ的热量,葡萄糖约为16.4kJ,蛋白质约为16.7kJ,提供能量最多的是油脂,蛋白质水解最终生成氨基酸。
②人体牙龈出血、患坏血病的原因主要是因为缺乏维生素C。
(3)①石墨烯具有十分良好的强度、柔韧、导电、导热、光学特性能,作电极是利用了石墨烯的导电性。
②生产硅酸盐水泥用到黏土和石灰石,高炉炼铁用到焦炭、石灰石等,都用到石灰石,故高炉炼铁和生产硅酸盐水泥都要用到的原料是石灰石,答案为b;
③没经过人工合成加工能直接从自然界获取的高分子材料叫天然高分子材料,则
a、舒适层是由棉布组成的,属于天然高分子材料,故a适合;
b、合成橡胶属于合成有机高分子材料,故b不适合;
c、复合材料结构组成的主气密层属于复合材料,故c不适合;
故答案选a;
④a、刚玉、金刚石的主要成分分别是氧化铝和碳,a不选;
b、大理石、石灰石的主要成分是碳酸钙,b选;
c、光导纤维、普通玻璃的主要成分分别是二氧化硅和硅酸盐,c不选。
答案选b。
⑤铜绿与盐酸反应生成氯化铁、二氧化碳和水,反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O。
B《有机化学基础》
(1)①结构相似,在分子组成上相差一个或若干个CH2原子团的同一类有机物互称为同系物。苯甲酸含有苯基和羧基,则与苯甲酸互为同系物的是苯乙酸(C6H5CH2COOH),答案选a;
②苯和乙烷难溶于水,乙醇与水互溶,则有机化合物易溶于水的是乙醇,答案选c;
③a. 乙酸和乙醛均与水互溶,不能用水鉴别,a错误;
b. 乙酸不能发生银镜反应,乙醛能发生银镜反应,可以用银氨溶液鉴别乙酸和乙醛,b正确;
c. 稀硫酸与二者均不反应,不能鉴别乙酸和乙醛,c错误;
答案选b;
(2)①扁桃酸的结构简式为C6H5CHOHCOOH,则分子中有6种不同化学环境的氢。
②根据扁桃酸的结构简式可知分子中含氧官能团的名称为羟基和羧基。
③羟基和羧基均与金属钠反应,则1 mol扁桃酸最多能与2mol金属钠反应
(3)①根据A的结构简式可知分子中含氧官能团的名称为醛基和醚键。
②A在酸性高锰酸钾的作用下醛基被氧化为羧基,则B的结构简式为 。
。
③B→C是羧基与甲醇中的羟基发生酯化反应,反应类型为取代反应或酯化反应。
④C的同分异构体D能发生银镜反应,说明含有醛基,能与FeCl3溶液发生显色反应,说明含有酚羟基。1molD最多能与2molNaOH反应,说明含有2个酚羟基,又因为D分子中有4种不同化学环境的氢,说明苯环上含有2个甲基、2个酚羟基和1个醛基,则符合条件的D一种结构简式为 。
。

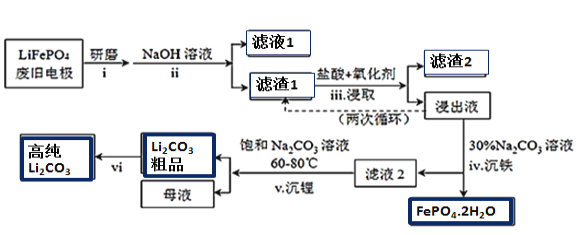
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。