题目内容
用无机矿物资源生产部分材料,其产品流程示意图如下:
下列有关说法不正确的是
| A.制取粗硅时生成的气体产物为CO |
| B.生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应 |
| C.黄铜矿冶炼铜时。SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
| D.粗硅制高纯硅时。提纯四氯化硅可用多次分馏的方法 |
B
解析试题分析:A、2C+SiO2 Si+2CO,正确;B、生产玻璃的过程中不涉及氧化还原反应,错误;C、SO2可用于生产硫酸,FeO可用作冶炼铁的原料,正确。D、四氯化硅熔沸点较低,提纯四氯化硅可用多次分馏的方法,正确。
Si+2CO,正确;B、生产玻璃的过程中不涉及氧化还原反应,错误;C、SO2可用于生产硫酸,FeO可用作冶炼铁的原料,正确。D、四氯化硅熔沸点较低,提纯四氯化硅可用多次分馏的方法,正确。
考点:考察元素及其化合物的性质。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl加热有类似升华现象 | 用加热法除去NaCl中的NH4Cl |
| B | Fe的金属活动性大于Cu | 用FeCl3溶液可以腐蚀Cu |
| C | 水解程度:NaHCO3<Na2CO3 | 溶解度:Na2CO3>NaHCO3 |
| D | HNO3具有不稳定性 | 浓HNO3应保存在棕色试剂瓶中 |
下列物质转化在给定条件下能实现的是
①Al2O3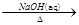 NaAlO2(aq)
NaAlO2(aq)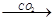 Al(OH)3
Al(OH)3
②S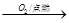 SO3
SO3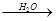 H2SO4
H2SO4
③饱和NaCl(aq)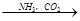 NaHCO3
NaHCO3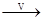 Na2CO3
Na2CO3
④Fe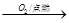 Fe3O4
Fe3O4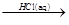 FeCl3
FeCl3
| A.①③ | B.②③ | C.②④ | D.①④ |
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 | 未出现红色沉淀 | 葡萄糖中不含有醛基 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成, 苯层呈紫色 | 白色沉淀可能为CuI |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多 且反应速率快 | HA酸性比HB强 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
下列依据相关实验得出的结论正确的是
| A.向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3 |
| B.向某溶液中加入稀硝酸再滴入Ba(NO3)2溶液产生白色沉淀,该溶液一定含SO42- |
| C.向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效 |
| D.向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
下列物质间的转化在给定条件下能实现的是
①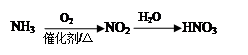
②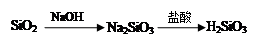
③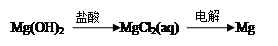
④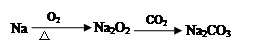
| A.②④ | B.③④ | C.①④ | D.①②③ |
下列说法正确的是( )
| A.将Cl2通人FeBr2溶液中,溶液颜色变黄,则Fe2+被氧化,Br-不一定参加了反应 |
| B.CO2、SO3、NO2和水反应均能生成酸,都属于酸性氧化物 |
| C.0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。其燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol |
| D.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |

 C
C
 A+B
A+B