题目内容
【题目】某工业废料含SiO2、FeS和CuS等物质,采用如下实验方案进行回收利用。请回答下列问题:
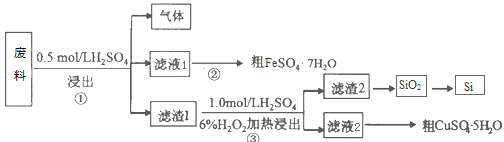
(1)已知步骤①中发生的化学反应为非氧化还原反应,写出产生气体的电子式_______,该气体可用足量的NaOH溶液吸收,该反应的离子方程式是__________________。
(2)步骤②的操作依次为______、_______、过滤、洗涤、干燥。滤渣2的主要成分是SiO2和S,写出步骤③涉及的化学方程式________________________________。
(3)所得硫酸亚铁晶体中的Fe2+,可以用_________________________(填试剂化学式)检验。
【答案】![]() H2S+2OH-=S2- +2H2O 蒸发浓缩 降温结晶 CuS+H2O2+H2SO4
H2S+2OH-=S2- +2H2O 蒸发浓缩 降温结晶 CuS+H2O2+H2SO4![]() CuSO4+S+2H2O NaOH溶液或Cl2、KSCN溶液
CuSO4+S+2H2O NaOH溶液或Cl2、KSCN溶液
【解析】
工业废料中含SiO2、FeS和CuS等物质,加入H2SO4溶液酸浸,FeS与硫酸反应产生H2S气体,二氧化硅不溶于硫酸,硫化铜难溶于酸,所以滤渣1为二氧化硅和硫化铜,滤液1为FeSO4溶液,将滤液1蒸发浓缩、冷却结晶、过滤洗涤、干燥得到FeSO47H2O,向滤渣1加入H2SO4溶液和H2O2溶液并加热,浸出得到滤渣2为SiO2,高温用C还原SiO2制备Si单质,CuS在酸性溶液中被H2O2氧化生成硫酸铜、硫单质和水,滤液蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸铜晶体。
(1) H2S为共价化合物,硫原子和两个氢原子形成共价键,电子式为:![]() ,H2S和NaOH溶液反应生成Na2S和H2O,反应的离子方程式为:H2S+2OH-=S2-+2H2O;
,H2S和NaOH溶液反应生成Na2S和H2O,反应的离子方程式为:H2S+2OH-=S2-+2H2O;
(2)步骤②的操作依次为:蒸发浓缩 降温结晶,过滤、洗涤、干燥。滤渣2的主要成分是SiO2和S,写出步骤③涉及的化学方程式:CuS+H2O2+H2SO4![]() CuSO4+S+2H2O;
CuSO4+S+2H2O;
(3)所得硫酸亚铁晶体中的Fe2+,可以向该溶液中加入NaOH溶液,若发生反应:Fe2++2OH-=Fe(OH)2↓,产生白色沉淀;或向该溶液中滴加KSCN溶液,无明显现象,再滴加几滴新制Cl2水,溶液变为血红色,发生反应方程式:2Fe2++Cl2=2Fe3++2Cl-, Fe3++3SCN-=Fe(SCN)3,使溶液变为血红色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


