题目内容
有机物A有如下转化关系:
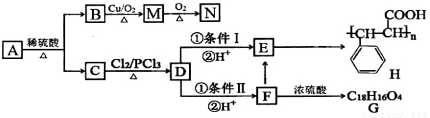
已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%。
②
根据以上信息,回答下列问题:
(1)B的分子式为__________;有机物D中含氧官能团名称是__________。
(2)A的结构简式为__________;检验M中官能团的试剂是__________。
(3)条件I为__________;D→F的反应类型为__________。
(4)写出下列转化的化学方程式:
F→E___________________________,
F→G___________________________。
(5)N的同系物X比N相对分子质量大14,符合下列条件的X的同分异构体有__________种(不考虑立体异构)
①含有苯环 ②能发生银镜反应 ③遇FeCl3溶液显紫色
写出其中核磁共振氢谱有五组峰,且吸收峰的面积之比为1∶1∶2∶2∶2的同分异构体的结构简式__________。
下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCI2溶液 | 生成白色沉淀 | 该溶液中不一定含有SO42- |
B | FeCl2溶液中,滴加KSCN溶和溴水 | 滴加KSCN溶液,无明显变化;滴加溴水后,溶液变红 | 氧化性:Br2>Fe3+ |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密A12O3薄膜且A12O3熔点高中Al |
A. A B. B C. C D. D
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变 成血红色 | Fe2+既有氧化性 又有还原性 |
B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
C | 室温下,向浓度均为0.1mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
A. A B. B C. C D. D





