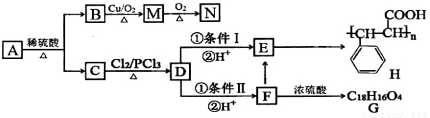
题目内容
下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCI2溶液 | 生成白色沉淀 | 该溶液中不一定含有SO42- |
B | FeCl2溶液中,滴加KSCN溶和溴水 | 滴加KSCN溶液,无明显变化;滴加溴水后,溶液变红 | 氧化性:Br2>Fe3+ |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密A12O3薄膜且A12O3熔点高中Al |
A. A B. B C. C D. D
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,发生如下反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) /mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) /mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T2时CH4的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平 衡向正反应方向移动
D. 保持其他条件不变, T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是( )
操作 | 现象 | 结论 | |
A | ①滴加稀HNO3②滴加BaCl2溶液 | 无明显现象白色沉淀 | 原溶液一定含 |
B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含 |
C | ①滴加稀HCl②滴加AgNO3溶液 | 无明显现象白色沉淀 | 原溶液一定含Cl- |
D | ①滴加KCSN溶液②滴加氯水 | 无明显现象溶液呈红色 | 原溶液一定含Fe2+ |
A. A B. B C. C D. D




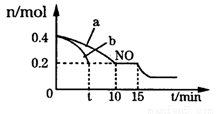
 CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。
CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。

 3H++PO23-
3H++PO23-