题目内容
(2013?泰安一模)硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4?5H2O),其中一种流程如下:
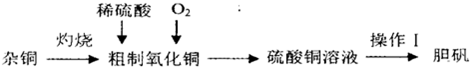
(1)操作I具体为
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气.反应完全后向其中加入过量
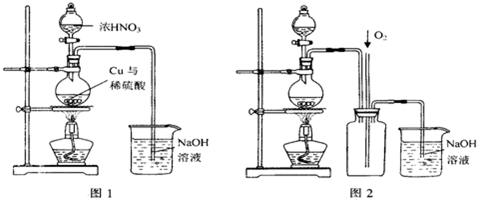
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O).
烧瓶内发生反应的离子方程式为
图2是图1的改进装置,其优点有①

(1)操作I具体为
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、过滤、烘干.(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是
ab
ab
(填字母代号).a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气.反应完全后向其中加入过量
Cu
Cu
(填化学式,下同),调节pH至4,生成Fe(OH)3
Fe(OH)3
沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4].(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O).
烧瓶内发生反应的离子方程式为
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
;图2是图1的改进装置,其优点有①
防止氢氧化钠溶液倒吸进入发生装置
防止氢氧化钠溶液倒吸进入发生装置
,②一氧化氮、二氧化氮有毒气体能被完全吸收
一氧化氮、二氧化氮有毒气体能被完全吸收
.
分析:(1)从溶液中获取晶体的方法是:蒸发浓缩、冷却结晶、过滤、烘干;
(2)铜能被部分有机物还原;
(3)调节溶液PH,加入的物质能和溶液中氢离子反应,从而提高溶液PH,但不能引入新的杂质;
(4)铜和浓硝酸反应生成硝酸铜和二氧化氮,和稀硝酸反应生成硝酸铜和一氧化氮,
图2装置能防止倒吸且有毒气体能完全被吸收.
(2)铜能被部分有机物还原;
(3)调节溶液PH,加入的物质能和溶液中氢离子反应,从而提高溶液PH,但不能引入新的杂质;
(4)铜和浓硝酸反应生成硝酸铜和二氧化氮,和稀硝酸反应生成硝酸铜和一氧化氮,
图2装置能防止倒吸且有毒气体能完全被吸收.
解答:解:(1)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶;
(2)a.灼烧过程中部分氧化铜被有机物还原生成铜单质,故正确;
b.灼烧不充分.铜未被完全氧化导致含有铜单质,故正确;
c.氧化铜在加热过程中不会分解生成铜,故错误;
d.加热条件下铜易被氧气氧化,故错误;
故选ab;
(3)除杂的原则,保证不引入杂质,加入氧化铜或碱式碳酸铜都能和酸反应从而提高溶液PH,且不引进新的杂质,铁离子生成氢氧化铁沉淀,从而得到纯净的硫酸铜晶体,
故答案为:CuO;Fe(OH)3;
(4)铜和浓硝酸反应生成硝酸铜和二氧化氮,和稀硝酸反应生成硝酸铜和一氧化氮,
离子反应方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
图2装置中充入氧气能平衡压强,所以能防止倒吸,二氧化氮和一氧化氮有毒,不能直接排空,且一氧化氮不易溶于水,充入氧气能使一氧化氮转化为二氧化氮,从而使二氧化氮、一氧化氮能全部被氢氧化钠溶液吸收,防止污染大气,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
①防止氢氧化钠溶液倒吸进入发生装置;②一氧化氮、二氧化氮有毒气体能被完全吸收.
故答案为:蒸发浓缩、冷却结晶;
(2)a.灼烧过程中部分氧化铜被有机物还原生成铜单质,故正确;
b.灼烧不充分.铜未被完全氧化导致含有铜单质,故正确;
c.氧化铜在加热过程中不会分解生成铜,故错误;
d.加热条件下铜易被氧气氧化,故错误;
故选ab;
(3)除杂的原则,保证不引入杂质,加入氧化铜或碱式碳酸铜都能和酸反应从而提高溶液PH,且不引进新的杂质,铁离子生成氢氧化铁沉淀,从而得到纯净的硫酸铜晶体,
故答案为:CuO;Fe(OH)3;
(4)铜和浓硝酸反应生成硝酸铜和二氧化氮,和稀硝酸反应生成硝酸铜和一氧化氮,
离子反应方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
图2装置中充入氧气能平衡压强,所以能防止倒吸,二氧化氮和一氧化氮有毒,不能直接排空,且一氧化氮不易溶于水,充入氧气能使一氧化氮转化为二氧化氮,从而使二氧化氮、一氧化氮能全部被氢氧化钠溶液吸收,防止污染大气,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
①防止氢氧化钠溶液倒吸进入发生装置;②一氧化氮、二氧化氮有毒气体能被完全吸收.
点评:本题考查了实验方案的设计、评价等知识点,明确物质的性质是解本题关键,难点是实验方案的评价,从实验的可操作性、简便性、安全性、环保等方面考虑,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( )
(2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( ) (2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.
(2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.