题目内容
(2010?江西模拟)短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层之和为13;B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素;D、E形成的单质在不同条件下可以生成两种不同的离子化合物;F是同周期元素中原子半径最小的.
(1)A、D以1:1形成化合物的电子式为
 .A、C形成最简单化合物的空间构型为
.A、C形成最简单化合物的空间构型为
(2)A、C形成的某化合物的相对分子质量与D2的相等,写出该化合物与足量盐酸反应的离子方程式:
(3)A、C、F形成的化合物是一种常见的化学肥料,该物质的水溶液中离子浓度的大小顺序为
(4)C、D两元素可组成价态相同且能相互转变的化合物,它们是
(5)F2与FD2均可用于自来水的杀菌消毒,若它们在杀菌过程中的还原产物相同,则消毒等体积的自来水,所需F2和FD2的物质的量之比为
(1)A、D以1:1形成化合物的电子式为


三角锥形
三角锥形
.B可形成晶体类型不同的多种单质,它们互称为同素异形体
同素异形体
.(2)A、C形成的某化合物的相对分子质量与D2的相等,写出该化合物与足量盐酸反应的离子方程式:
N2H4+2H+=N2H62+
N2H4+2H+=N2H62+
.(3)A、C、F形成的化合物是一种常见的化学肥料,该物质的水溶液中离子浓度的大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
.(4)C、D两元素可组成价态相同且能相互转变的化合物,它们是
NO2和N2O4
NO2和N2O4
(填化学式).(5)F2与FD2均可用于自来水的杀菌消毒,若它们在杀菌过程中的还原产物相同,则消毒等体积的自来水,所需F2和FD2的物质的量之比为
5:2
5:2
.分析:B的化合物种类繁多,数目庞大,则B为C元素,能形成多种化合物,C、D是空气中含量最多的两种元素,又D的原子序数大于C,则C为N元素,D为O元素,D、E形成的单质在不同条件下可以生成两种不同的离子化合物,则E为Na元素,可分别形成Na2O、Na2O2,F是同周期元素中原子半径最小的,应为Cl元素,A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层之和为13,则A的原子核外电子层数为13-2-2-2-3-3=1,则A为H元素,结合元素对应单质、化合物的结构和性质解答该题.
解答:解:B的化合物种类繁多,数目庞大,则B为C元素,能形成多种化合物,C、D是空气中含量最多的两种元素,又D的原子序数大于C,则C为N元素,D为O元素,D、E形成的单质在不同条件下可以生成两种不同的离子化合物,则E为Na元素,可分别形成Na2O、Na2O2,F是同周期元素中原子半径最小的,应为Cl元素,A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层之和为13,则A的原子核外电子层数为13-2-2-2-3-3=1,则A为H元素,
(1)A、D以1:1形成化合物为H2O2,电子式为 ,A、C形成最简单化合物为NH3,空间构型为三角锥形,由同种元素形成的不同单质为同素异形体,
,A、C形成最简单化合物为NH3,空间构型为三角锥形,由同种元素形成的不同单质为同素异形体,
故答案为: ;三角锥形;同素异形体;
;三角锥形;同素异形体;
(2)O2的相对分子质量为32,与之相对分子质量相等的N、H化合物为N2H4,
与盐酸反应的离子方程式为N2H4+2H+=N2H62+,故答案为:N2H4+2H+=N2H62+;
(3)A、C、F形成的化合物为NH4Cl,为强酸弱碱盐,水解呈酸性,溶液中的离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)C、D两元素可组成价态相同且能相互转变的化合物为NO2和N2O4,存在2NO2 N2O4,故答案为:NO2和N2O4;
N2O4,故答案为:NO2和N2O4;
(5)Cl2与ClO2均可用于自来水的杀菌消毒,若它们在杀菌过程中的还原产物相同,则反应中得到电子的物质的量相等,则有2n(Cl2)×(0-(-1))=n(ClO2)×(4-(-1)),所以n(Cl2):n(ClO2)=5:2,
故答案为:5:2.
(1)A、D以1:1形成化合物为H2O2,电子式为
 ,A、C形成最简单化合物为NH3,空间构型为三角锥形,由同种元素形成的不同单质为同素异形体,
,A、C形成最简单化合物为NH3,空间构型为三角锥形,由同种元素形成的不同单质为同素异形体,故答案为:
 ;三角锥形;同素异形体;
;三角锥形;同素异形体;(2)O2的相对分子质量为32,与之相对分子质量相等的N、H化合物为N2H4,
与盐酸反应的离子方程式为N2H4+2H+=N2H62+,故答案为:N2H4+2H+=N2H62+;
(3)A、C、F形成的化合物为NH4Cl,为强酸弱碱盐,水解呈酸性,溶液中的离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)C、D两元素可组成价态相同且能相互转变的化合物为NO2和N2O4,存在2NO2
 N2O4,故答案为:NO2和N2O4;
N2O4,故答案为:NO2和N2O4;(5)Cl2与ClO2均可用于自来水的杀菌消毒,若它们在杀菌过程中的还原产物相同,则反应中得到电子的物质的量相等,则有2n(Cl2)×(0-(-1))=n(ClO2)×(4-(-1)),所以n(Cl2):n(ClO2)=5:2,
故答案为:5:2.
点评:本题考查元素的推断以及盐类的水解、氧化还原反应等问题,题目难度中等,本题中注意把握题中信息,正确推断元素的种类为解答该题的关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
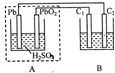 (2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )
(2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )