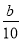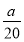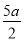题目内容
将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,用电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体生成。下列叙述中正确的是( )
①混合气体中O2和CH4的体积比为2:1
②残留物只有Na2CO3
③混合气体中O2与CH4的物质的量之比为1:2
④残留物只有Na2CO3和NaOH
A.①② B.②③ C.③④ D.①④
C
【解析】CH4+2O2 CO2+2H2O……①;2Na2O2+2CO2=2Na2CO3+O2……②;2Na2O2+2H2O=4NaOH+O2↑……③。最后容器内压强为零,残留物溶于水无气体生成,说明反应后没有Na2O2和任何气体剩余,可以写出一个总反应方程式:①×2+②+③×2:2CH4+O2+6Na2O2=2Na2CO3+8NaOH,故③④正确。
CO2+2H2O……①;2Na2O2+2CO2=2Na2CO3+O2……②;2Na2O2+2H2O=4NaOH+O2↑……③。最后容器内压强为零,残留物溶于水无气体生成,说明反应后没有Na2O2和任何气体剩余,可以写出一个总反应方程式:①×2+②+③×2:2CH4+O2+6Na2O2=2Na2CO3+8NaOH,故③④正确。

除去下列物质中的杂质(括号中为杂质)选用试剂正确的是( )
A.Fe2O3(Al2O3)用盐酸
B.Fe2O3(Al2O3)用氨水
C.Mg(Al)用纯碱溶液
D.MgCl2(AlCl3)用氢氧化钠溶液和盐酸
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。