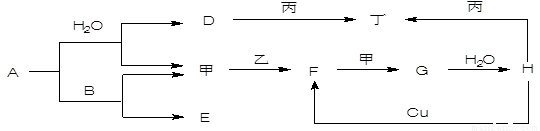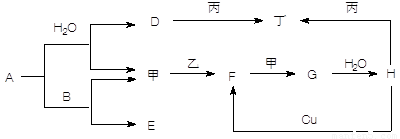题目内容
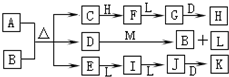 如图转化关系中,常温下E、F、L、I为无色气体,F是形成酸雨的主要原因之一,D为无色液体,M是淡黄色固体,在E的水溶液中通入过量的F得到A.
如图转化关系中,常温下E、F、L、I为无色气体,F是形成酸雨的主要原因之一,D为无色液体,M是淡黄色固体,在E的水溶液中通入过量的F得到A.试回答下列问题:
(1)A的晶体中含有的化学键为
(2)写出D→B的化学反应方程式
(3)写出E与H反应生成的正盐溶液中的离子浓度大小关系
(4)E作为燃料电池燃气时,发生的总反应为:E+O2→N2+H2O,KOH溶液为电解质溶液,负极反应式是
(5)Zn与K的稀溶液反应,当有1mol K参与反应时,有0.8mol电子转移,此时K的还原产物可能是
(6)将少量的F通入NaClO溶液中,其离子反应方程式为
分析:常温下,D为无色液体,则D为H2O,M是淡黄色固体,且能和水反应,则M是Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,L是气体,所以L是O2,B是NaOH,F是形成酸雨的主要原因之一,F为SO2,F和氧气反应生成G,G为SO3,三氧化硫和水反应生成H,H为H2SO4,E是气体,能连续被氧化生成J,J和水反应生成K,则E是NH3,I是NO,J是NO2,K是HNO3,在E的水溶液中通入过量的F得到A,则A是NH4HSO3,根据元素守恒知,B是NaOH,C为Na2SO3,结合物质的性质分析解答.
解答:解:常温下,D为无色液体,则D为H2O,M是淡黄色固体,且能和水反应,则M是Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,L是气体,所以L是O2,B是NaOH,F是形成酸雨的主要原因之一,F为SO2,F和氧气反应生成G,G为SO3,三氧化硫和水反应生成H,H为H2SO4,E是气体,能连续被氧化生成J,J和水反应生成K,则E是NH3,I是NO,J是NO2,K是HNO3,在E的水溶液中通入过量的F得到A,则A是NH4HSO3,根据元素守恒知,B是NaOH,C为Na2SO3,
(1)A是NH4HSO3,铵根离子和亚硫酸氢根离子之间存在离子键,铵根离子中存在配位键,氧原子和硫原子之间存在共价键,所以A中含有离子键、共价键和配位键,B是氢氧化钠,钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,所以其电子式为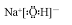 ,
,
故答案为:离子键、共价键、配位键;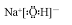 ;
;
(2)过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,7.8g过氧化钠和水反应转移电子数=
×(1-0)×NA/mol=6.02×1022 或0.1NA,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;6.02×1022 或0.1NA;
(3)E与H反应生成的正盐为(NH4)2SO4,硫酸铵是强酸弱碱盐,其溶液呈酸性,所以c(H+)>c(OH-),
根据电荷守恒得c(H+)+c(NH4+)=2c(SO42-)+c(OH-),所以c(NH4+)>c(SO42-),水电离较微弱,所以c(SO42-)>c(H+),则离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)负极上燃料失电子发生氧化反应,根据生成物知,负极上电极反应式为4 NH3-12e-+12OH-═2N2+12 H2O或2 NH3-6e-+6OH-═N2+6H2O,
故答案为:4 NH3-12e-+12OH-═2N2+12 H2O或2 NH3-6e-+6OH-═N2+6H2O;
(5)Zn与硝酸的稀溶液反应,当有1molHNO3参与反应时,有0.8mol电子转移,锌参加反应的物质的量=
=0.4mol,所以实际上参加氧化还原反应的硝酸的物质的量是0.2mol,
则产物中的化合价=5-
=+1,所以其产物可能是N2O或NH4NO3,
故答案为:N2O或NH4NO3;
(6)F是SO2,少量的二氧化硫和次氯酸钠发生氧化还原反应生成硫酸钠、氯化钠和次氯酸,反应方程式为SO2+3ClO-+H2O═SO42-+Cl-+2HClO,
故答案为:SO2+3ClO-+H2O═SO42-+Cl-+2HClO.
(1)A是NH4HSO3,铵根离子和亚硫酸氢根离子之间存在离子键,铵根离子中存在配位键,氧原子和硫原子之间存在共价键,所以A中含有离子键、共价键和配位键,B是氢氧化钠,钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,所以其电子式为
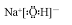 ,
,故答案为:离子键、共价键、配位键;
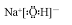 ;
;(2)过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,7.8g过氧化钠和水反应转移电子数=
| 7.8g |
| 78g/mol |
故答案为:2Na2O2+2H2O═4NaOH+O2↑;6.02×1022 或0.1NA;
(3)E与H反应生成的正盐为(NH4)2SO4,硫酸铵是强酸弱碱盐,其溶液呈酸性,所以c(H+)>c(OH-),
根据电荷守恒得c(H+)+c(NH4+)=2c(SO42-)+c(OH-),所以c(NH4+)>c(SO42-),水电离较微弱,所以c(SO42-)>c(H+),则离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)负极上燃料失电子发生氧化反应,根据生成物知,负极上电极反应式为4 NH3-12e-+12OH-═2N2+12 H2O或2 NH3-6e-+6OH-═N2+6H2O,
故答案为:4 NH3-12e-+12OH-═2N2+12 H2O或2 NH3-6e-+6OH-═N2+6H2O;
(5)Zn与硝酸的稀溶液反应,当有1molHNO3参与反应时,有0.8mol电子转移,锌参加反应的物质的量=
| 0.8mol |
| 2 |
则产物中的化合价=5-
| 0.8mol |
| 0.2mol |
故答案为:N2O或NH4NO3;
(6)F是SO2,少量的二氧化硫和次氯酸钠发生氧化还原反应生成硫酸钠、氯化钠和次氯酸,反应方程式为SO2+3ClO-+H2O═SO42-+Cl-+2HClO,
故答案为:SO2+3ClO-+H2O═SO42-+Cl-+2HClO.
点评:本题考查了物质的性质及物质间的反应,正确推断物质是解本题关键,(5)是解答难点,注意该题中硝酸不仅作氧化剂还起酸作用,根据参加氧化还原反应的硝酸确定产物中N元素的化合价,也为解答易错点.

练习册系列答案
相关题目