题目内容
【题目】Ⅰ.(多选)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是(____)
A.SiX4难水解 B.SiX4是共价化合物
C.NaX易水解 D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
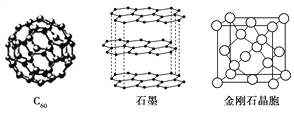
回答下列问题:
(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,列式表示碳原子在晶胞中的空间占有率________(不要求计算结果)。
【答案】 BD 同素异形体 sp3 sp2 分子 混合 σ键 σ键 π键(或大π键或p-pπ键) 8 ![]()
![]() =
=![]()
【解析】Ⅰ.SiX4易水解生成硅酸和卤化氢,A错误;SiX4只含有共价键,是共价化合物, B正确;NaX是离子化合物,阴、阳离子不易水解,C错误;NaX是离子化合物,SiX4是共价化合物,NaX的熔点高,D正确;正确选项BD。
Ⅱ.(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为同素异形体;正确答案:同素异形体。
(2)根据晶胞图中可知:金刚石中碳原子形成4条共价键,为sp3杂化; 石墨烯为片层结构,碳原子以sp2杂化;正确答案:. sp3;sp2 。
(3)C60只含有共价键,属于分子晶体;石墨既含有共价键,又含有分子间作用力,属于混合晶体;正确答案:分子; 混合。
(4)金刚石中只存在C—C间的σ共价键,而石墨层内的C—C间存在σ共价键和π键,键能大,键长变小;正确答案:σ键;σ键; π键(或大π键或p-pπ键)。
(5)金刚石晶胞中含有碳原子数为8×1/8+6×1/2+4=8,金刚石不是紧密堆积结构,设体心有一个球,沿体对角线方向有5个球,体对角线距离为8r=a×√3, a=8r/√3,原子的体积V(原子)=4/3πr3×8=32πr3/3,晶胞的体积 V(晶胞)= a3=(8r/√3)3,空间占有率= V(原子)/ V(晶胞)= √3π/16;正确答案:8; ![]() ;
;![]() =
=![]() 。
。

 名校课堂系列答案
名校课堂系列答案