题目内容
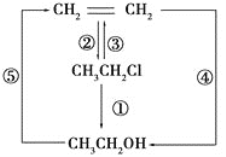
【题目】请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。
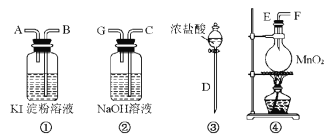
请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,______接_____,_____接____。
(2)圆底烧瓶中发生反应的化学方程式为____________。
(3)证明Cl2比I2的氧化性强的实验现象是_____________,反应的离子方程式是________。
(4)装置②的作用是___________。
(5)若要证明Cl2的氧化性比Br2强,则需做的改动是_________。
【答案】F B A C MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 装置①中KI-淀粉溶液出现蓝色 Cl2+2I-=2Cl-+I2 吸收多余的氯气 将①中KI淀粉溶液换成NaBr溶液
MnCl2+Cl2↑+2H2O 装置①中KI-淀粉溶液出现蓝色 Cl2+2I-=2Cl-+I2 吸收多余的氯气 将①中KI淀粉溶液换成NaBr溶液
【解析】
证明Cl2的氧化性比I2的氧化性强,先由④制备氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,将氯气通入①中发生反应:Cl2+2I-=2Cl-+I2,淀粉遇碘变蓝,氯气有毒,多余氯气用氢氧化钠溶液吸收;
MnCl2+Cl2↑+2H2O,将氯气通入①中发生反应:Cl2+2I-=2Cl-+I2,淀粉遇碘变蓝,氯气有毒,多余氯气用氢氧化钠溶液吸收;
(1)设计实验证明Cl2的氧化性比I2的氧化性强的装置依次是:制取氯气,氯气氧化碘离子,尾气处理;
(2)用二氧化锰与浓盐酸加热制备氯气;
(3)碘遇淀粉变蓝色即可证明氯气的氧化性强于碘;
(4)涉及氯气的实验必须进行尾气处理;
(5)氯气能将溴离子氧化为单质,证明氯气的氧化性强于溴.
(1)制取氯气的装置为:DEF,氯气氧化碘离子的实验装置为:BA,尾气处理连C,导管要长进短出,
故答案为:F;B;A;C;
(2)用二氧化锰与浓盐酸加热制备氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)氯气能将碘离子氧化为碘单质,即2I-+Cl2=I2+2Cl-,碘遇淀粉变蓝色,证明Cl2比I2的氧化性强,
故答案为:装置①中KI-淀粉溶液出现蓝色;2I-+Cl2=I2+2Cl-;
(4)涉及氯气的实验必须进行尾气处理,装置②用氢氧化钠溶液吸收多余的氯气,
故答案为:吸收多余的氯气;
(5)氯气能将溴离子氧化为单质,可以证明氯气的氧化性强于溴,所以将装置①中KI-淀粉溶液改为NaBr溶液即可证明,
故答案为:将①中KI淀粉溶液换成NaBr溶液。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案