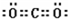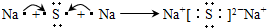题目内容
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B 原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A
(2)D元素位于周期表中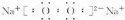
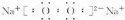 ,所含化学键
,所含化学键
(3)AB2的电子式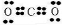
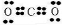 写出AB2与C2B2反应的化学方程式
写出AB2与C2B2反应的化学方程式
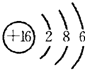
(4)画出B的原子结构简图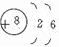
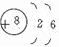 .
.
(5)电子式表示化合物 C2D 的形成过程: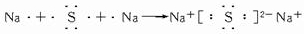
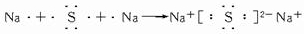 .
.
(1)元素名称:A
C
C
; BO
O
; CNa
Na
; DS
S
.(2)D元素位于周期表中
三
三
周期ⅥA
ⅥA
族.C2B2的电子式: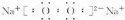
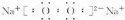
离子键和共价键
离子键和共价键
.(3)AB2的电子式
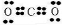
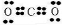
2CO2+2Na2O2=2Na2CO3+O2↑
2CO2+2Na2O2=2Na2CO3+O2↑
.(4)画出B的原子结构简图
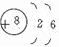
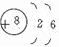
(5)电子式表示化合物 C2D 的形成过程:
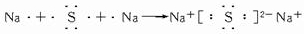
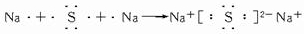
分析:C燃烧时使火焰呈现黄色,则C为Na;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,则B为O,生成Na2O2、D为S;A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,应为C元素,D单质为黄色,应为S,结合对应物质的性质解答该题.
解答:解:C燃烧时使火焰呈现黄色.则C为Na;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,则B为O,生成Na2O2、D为S;A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,应为C元素,D单质为黄色,应为S,
(1)由以上分析可知A为C、B为O、C为Na、D为S,故答案为:C;O;Na;S;
(2)D为S以上,原子核外有3个电子层,最外层电子数为6,应位于周期表第三周期第ⅥA族,C2B2为Na2O2,电子式为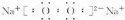 ,含有离子键和共价键,
,含有离子键和共价键,
故答案为:三;ⅥA;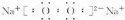 ;离子键和共价键;
;离子键和共价键;
(3)AB2为CO2,为共价化合物,电子式为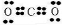 ,CO2与Na2O2反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,
,CO2与Na2O2反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,
故答案为: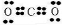 ;2CO2+2Na2O2=2Na2CO3+O2↑;
;2CO2+2Na2O2=2Na2CO3+O2↑;
(4)B为O,原子核外有2个电子层,最外层电子数为6,原子结构示意图为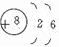 ,故答案为:
,故答案为: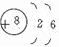 ;
;
(5)C2D为Na2S,电子式表示形成过程可为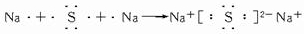 ,
,
故答案为: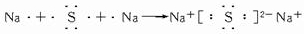 .
.
(1)由以上分析可知A为C、B为O、C为Na、D为S,故答案为:C;O;Na;S;
(2)D为S以上,原子核外有3个电子层,最外层电子数为6,应位于周期表第三周期第ⅥA族,C2B2为Na2O2,电子式为
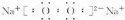 ,含有离子键和共价键,
,含有离子键和共价键,故答案为:三;ⅥA;
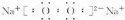 ;离子键和共价键;
;离子键和共价键;(3)AB2为CO2,为共价化合物,电子式为
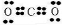 ,CO2与Na2O2反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,
,CO2与Na2O2反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,故答案为:
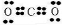 ;2CO2+2Na2O2=2Na2CO3+O2↑;
;2CO2+2Na2O2=2Na2CO3+O2↑;(4)B为O,原子核外有2个电子层,最外层电子数为6,原子结构示意图为
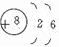 ,故答案为:
,故答案为: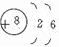 ;
;(5)C2D为Na2S,电子式表示形成过程可为
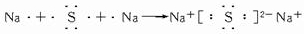 ,
,故答案为:
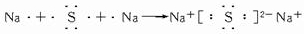 .
.点评:本题考查原子结构和元素周期律的相互关系,题目难度中等,注意正确推断元素的种类为解答该题的关键,注意把握电子式的书写以及用电子式表示的形成过程的方法.

练习册系列答案
相关题目