题目内容
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484.0 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:__________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
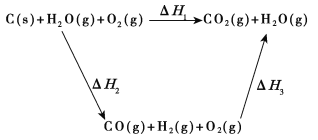
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请甲、乙两同学观点正确的是_____(填“甲”或“乙”);判断的理由是_________________________________________。
(3)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:
①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
【答案】C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ·mol-1乙甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3且ΔH2>0)②④
【解析】
(1)①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ/mol,②2H2(g)+O2(g)===2H2O(g) ΔH=-484.0 kJ·mol-1,③2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1,根据盖斯定律,![]() 得:C(石墨,s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol,故答案为:C(石墨,s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol;
得:C(石墨,s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol,故答案为:C(石墨,s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol;
(2)化学反应不管是一步完成还是分几步完成,其反应热是相同的,也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;煤转化为水煤气要吸收热量,故答案为:乙;甲同学忽略了煤转化为水煤气要吸收热量;
(3)“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照1:1反应,则只要各选项中的化学式能化为形式(CO)1(H2)1,都是正确的。①甲醇(CH4O)可变为(CO)1(H2)2,所以①不符合要求;②甲醛(CH2O)可变为(CO)1(H2)1,②符合要求;③甲酸(CH2O2)不能变为(CO)1(H2)1的形式,所以理论上③不符合要求;④乙酸(C2H4O2)可变为(CO)2(H2)2,所以理论上④符合要求;故答案为:②④。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:

(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。