��Ŀ����
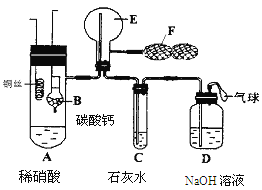
����Ŀ����ͼ1��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ�����������ձ���XΪ�����ӽ���Ĥ���밴Ҫ��ش�������⣺

��1������ȼ�ϵ�ظ����缫��Ӧʽ��___________�������缫��Ӧʽ��___________________
��2��ʯī(C)Ϊ__________������缫��ӦʽΪ____________________________�������ܷ�Ӧ�����ӷ���ʽΪ__________________________________________________
��3�����ڱ�״���£���2.24 L�����μӷ�Ӧ�����װ������������ͭ������Ϊ_________g ��
��4��������װ���еļ��黻�ɼ״�(CH3OH),KOH��Һ����ϡ���ᣬ���缫��ӦʽΪ___________�����ĵ�������ʱ����Ҫ������״������ʵ���֮��Ϊ_________��
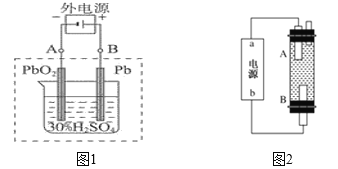
��5��NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ����ͼ2���õ����ʹ�ù�����ʯīI�缫������������Y����缫��ӦʽΪ________________________________
���𰸡�CH4+10OH--8e����CO32-+7H2OO2+2H2O+4 e����4OH-��2Cl����2e����Cl2����2Cl��+2H2O![]() 2OH-+H2��+Cl2��12.8gCH3OH-6e��+H2O=CO2+6H+3:4NO2+NO3-��2e�� =N2O5
2OH-+H2��+Cl2��12.8gCH3OH-6e��+H2O=CO2+6H+3:4NO2+NO3-��2e�� =N2O5
��������
��1��ȼ�ϵ���У�������Ͷ��ȼ��������Ͷ�ż���ĵ缫�Ǹ�����������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CH4+10OH--8e����CO32-+7H2O���������������õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��O2+2H2O+4e����4OH-��
�ʴ�Ϊ��CH4+10OH--8e����CO32-+7H2O��O2+2H2O+4e����4OH-��
��2������Ͷ���������ĵ缫��������������װ����ʯī�缫��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��2Cl����2e��=Cl2���������ܷ�Ӧ�����ӷ���ʽΪ2Cl��+2H2O![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
�ʴ�Ϊ������2Cl����2e��=Cl2����2Cl��+2H2O![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
��3�����������ת�Ƶ�������ȣ����ڱ�״���£���2.24L�����μӷ�Ӧ����ת�Ƶ��ӵ����ʵ���=![]() ��4=0.4mol����װ��������������ͭ��������ͭ������Ϊxg��
��4=0.4mol����װ��������������ͭ��������ͭ������Ϊxg��
2Cu 2++2e��=Cu
2mol 64g
0.4mol xg
���x=12.8��
�ʴ�Ϊ��12.8��
��4���ڼ״�ȼ�ϵ���У���������ȼ�ϼ״�����ʧ���ӵ�������Ӧ�������Ի����£������缫��ӦʽΪCH3OH-6e��+H2O=CO2+6H+���ɵ缫��Ӧʽ��֪��1mol CH4ת��8mol������1mol CH3OHת��6mol���������ݵ����غ㣬�����ĵ�������ʱ����ת�Ƶ��ӵ����ʵ�����ͬʱ����Ҫ������״������ʵ���֮��Ϊ![]() =3:4��
=3:4��
�ʴ�Ϊ��CH3OH-6e��+H2O=CO2+6H+��3:4��
��5�������ڢ�缫�Ϸ�����ԭ��Ӧ���缫���Ϸ���������Ӧ��NO2���������ɵ�������ֻ����N2O5���缫���ϵĵ缫��ӦʽΪ��NO2+NO3-��2e�� =N2O5��
�ʴ�Ϊ��NO2+NO3-��2e�� =N2O5��