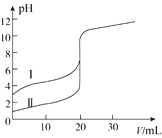
题目内容
【题目】用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是( )
A.直线形;平面三角形
B.V形;三角锥形
C.直线形;三角锥形
D.V形;平面三角形
【答案】D
【解析】解:H2S中S原子孤电子对数为 ![]() =2,价层电子对数为2+2=4,故为V形结构,而CH2O中C原子故电子对数为
=2,价层电子对数为2+2=4,故为V形结构,而CH2O中C原子故电子对数为 ![]() =0,价层电子对数为3+0=3,故其为平面三角形结构,
=0,价层电子对数为3+0=3,故其为平面三角形结构,
故选:D.
分子中中心原子价层电子对数=σ键数+孤电子对数,如果价层电子对数是4且不含孤电子对,则为正四面体结构,如果价层电子对数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对个数是4且含有2个孤电子对,则为V形,若价层电子对数为3,不含孤电子对,则为平面三角形,若有1对孤电子对,则为角形.

练习册系列答案
相关题目
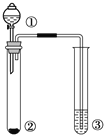
【题目】利用右图所示装置进行下列实验,能正确进行实验并得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氨水 | CaO | AlCl3溶液 | 制备氢氧化铝 | |
B | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si | |
D | 稀硫酸 | Na2S | Ag2SO4浊液 | Ksp(Ag2SO4)>Ksp(Ag2S) |
A. A B. B C. C D. D