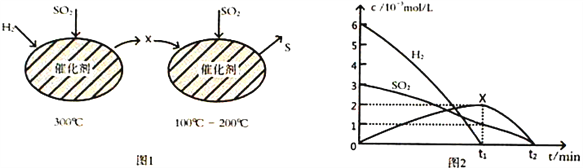
题目内容
【题目】已知在溶液中 。室温下,在实验室里用0.01 mol·L-1的氢氧化钠溶液滴定20 mL的0.01 mol·L-1HX溶液,滴定曲线如图所示。下列叙述正确的是( )
。室温下,在实验室里用0.01 mol·L-1的氢氧化钠溶液滴定20 mL的0.01 mol·L-1HX溶液,滴定曲线如图所示。下列叙述正确的是( )
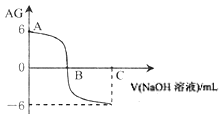
A. B点时c(X-) >c(Na+)
B. 室温时0.01 mol·L-1的HX溶液pH=6
C. A点时溶液中水的电离程度大于纯水的电离程度
D. 若C点时加入NaOH溶液40 mL,所得溶液中:c(X-)+2 c(HX) = c(OH-) - c(H+)
【答案】D
【解析】A. B点时,AG=0,即 =0,则c(H+)= c(OH-) ,溶液呈中性,根据溶液中电荷守恒式c(H+) +c(Na+)=c(X-)+c(OH-)可知,c(X-) =c(Na+),故A错误;B. 根据图象可知,0.01 mol/LHX溶液的AG=6,即
=0,则c(H+)= c(OH-) ,溶液呈中性,根据溶液中电荷守恒式c(H+) +c(Na+)=c(X-)+c(OH-)可知,c(X-) =c(Na+),故A错误;B. 根据图象可知,0.01 mol/LHX溶液的AG=6,即 =6,常温下水的离子积常数Kw=c(H+)×c(OH-)=10-14,解得c(H+)=10-4mol/L,溶液的pH=4,故B错误;C. HX是弱酸,酸抑制水的电离,所以A点时溶液中水的电离程度小于纯水的电离程度,故C错误;D. 若C点时加入NaOH溶液40 mL,充分反应后得到等浓度的NaX和NaOH的混合溶液,根据溶液中电荷守恒和物料守恒列式得:①c(H+) +c(Na+)=c(X-)+c(OH-),②2c(X-)+2 c(HX)=c(Na+),联立得:c(X-)+2 c(HX)+c(H+)=c(OH-),即c(X-)+2 c(HX) = c(OH-)-c(H+),故D正确;答案选D。
=6,常温下水的离子积常数Kw=c(H+)×c(OH-)=10-14,解得c(H+)=10-4mol/L,溶液的pH=4,故B错误;C. HX是弱酸,酸抑制水的电离,所以A点时溶液中水的电离程度小于纯水的电离程度,故C错误;D. 若C点时加入NaOH溶液40 mL,充分反应后得到等浓度的NaX和NaOH的混合溶液,根据溶液中电荷守恒和物料守恒列式得:①c(H+) +c(Na+)=c(X-)+c(OH-),②2c(X-)+2 c(HX)=c(Na+),联立得:c(X-)+2 c(HX)+c(H+)=c(OH-),即c(X-)+2 c(HX) = c(OH-)-c(H+),故D正确;答案选D。

练习册系列答案
相关题目