题目内容
【题目】X、Y、Z、W、T是原子序数依次增大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻, Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1) 写出W元素在周期表中的位置为________________。
(2) 由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的浓溶液只有在加热条件下能与金属铜反应,该反应的化学方程式为__________________。
(3) Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:___________________。
(4) Y和T两元素的非金属性强弱为Y_________T (填“>” “<”或者“=”)。可以验证该结论的方法是____________。
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
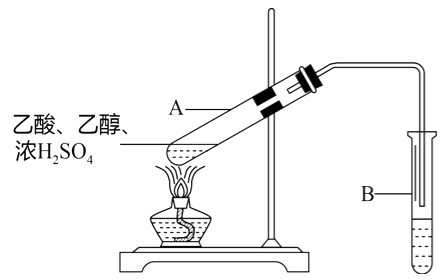
(5) 某化学兴趣小组欲通过实验探究元素N、C、Si非金属性强弱。实验装置如图:

①溶液a为_____________溶液、溶液b为___________溶液(均写化学式)。
②溶液C中反应的离子方程式为_____________________。
③经验证,N、C、Si的非金属性由强到弱为____________________。
【答案】 第三周期第VIA族 Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O NH3 + H+ ==NH4+ < CDE HNO3 NaHCO3 CO2 + H2O + SiO32﹣==CO32﹣+H2SiO3↓ N>C>Si
CuSO4 + SO2↑ + 2H2O NH3 + H+ ==NH4+ < CDE HNO3 NaHCO3 CO2 + H2O + SiO32﹣==CO32﹣+H2SiO3↓ N>C>Si
【解析】X、Y、Z、W、T是原子序数依次增大的五种短周期元素,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,T的单质常用于自来水的杀菌消毒,则T为Cl元素。
根据上述分析可知,X为H元素,Y为N元素,Z为O元素,W为S元素,T为Cl元素。
(1)W为S元素,位于元素周期表中第三周期第VIA族,故答案为:第三周期第VIA族;
(2)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的浓溶液只有在加热条件下能与铜反应,则该酸为硫酸,浓硫酸与Cu 反应生成硫酸铜、二氧化硫与水,反应化学方程式为2H2SO4(浓) + Cu![]() CuSO4 + 2H2O +SO2↑,故答案为:2H2SO4(浓) + Cu
CuSO4 + 2H2O +SO2↑,故答案为:2H2SO4(浓) + Cu![]() CuSO4 + 2H2O +SO2↑;
CuSO4 + 2H2O +SO2↑;
(3)Y元素的气态氢化物为氨气,与其最高价氧化物的水化物硝酸可以相互反应,生成硝酸铵和水,其离子方程式为NH3+H+=NH4+;故答案为:NH3+H+=NH4+;
(4)Y为N元素,T为Cl元素,N的非金属性小于Cl;A.氢化物的沸点是物理性质,不能通过沸点的高低来比较这两种元素的非金属性强弱,故A不选;B.元素所形成的最高价含氧酸的酸性越强,元素的非金属性越强,不是最高价含氧酸,不能判断非金属性强弱,故B不选;C.元素的气态氢化物越稳定,元素的非金属性越强,所以比较这两种元素的气态氢化物的稳定性,能判断非金属性强弱,故C选;D.元素单质与氢气化合越容易,则元素的非金属性越强,故D选;E.元素气态氢化物的还原性越强,元素的非金属性越弱,所以比较这两种元素气态氢化物的还原性,能判断元素的非金属性强弱,故E选;故答案为:<;CDE;
(5)探究元素N、C、Si非金属性强弱,通过比较硝酸、碳酸和硅酸的酸性强弱即可;
①溶液a与碳酸盐反应生成二氧化碳,然后通过饱和的碳酸氢钠溶液洗气,溶液a、b分别为HNO3溶液、NaHCO3溶液,故答案为:HNO3;NaHCO3;
②溶液C中,二氧化碳与硅酸钠溶液反应,反应的离子方程式为CO2+H2O+SiO32-=CO32-+H2SiO3↓;故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓;
③经验证,酸性:硝酸>碳酸>硅酸,所以N、C、Si的非金属性由强到弱:N>C>Si,故答案为:N>C>Si。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案