题目内容
【题目】CO2的转化和重整受到越来越多的关注,它是有效应对全球气候变化、促进低碳社会构建的重要方法。
(1)热化学转化法。
CO2催化加氢合成CH4,其过程中主要发生下列反应:
反应Ⅰ:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
反应Ⅱ:CO(g)+H2O (g)=CO2(g)+H2(g);ΔH=+2.8 kJ·mol-1
反应Ⅲ:2CO(g)+O2(g)=2CO2(g);ΔH=-566.0 kJ·mol-1
则反应CO2(g)+4H2(g)=CH4(g)+2H2O(g) 的ΔH=________kJ·mol-1。
(2)CO2催化还原法。
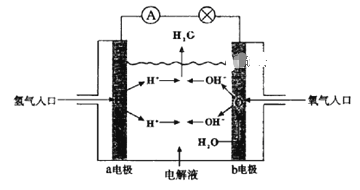
图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当有1 mol CO2反应时,直接传递的电子物质的量为________mol。
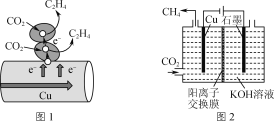
(3)CO2电化学催化重整法。
①图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为______________________,电解一段时间后,阳极区溶液pH减小,其原因是__________________。
②CO2与CH4在催化剂作用下合成乙酸,反应的化学方程式为________。
(4)CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。
①研究发现金属杂多酸盐中x对CO2转化率的影响如图3所示,由图3得出催化效果最好的金属杂多酸盐化学式是________。
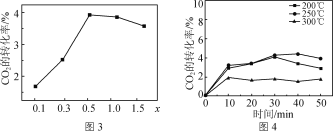
②催化剂在温度不同时对CO2转化率的影响如图4所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因为__________________________________。
【答案】-252.9 6 CO2+8e-+6H2O=CH4+8OH- OH-在阳极被氧化生成O2 CH4+CO2![]() CH3COOH [Co0.5H2PW12O40]或[CoH4P2W24O80] 温度过高,可能会导致催化剂失活
CH3COOH [Co0.5H2PW12O40]或[CoH4P2W24O80] 温度过高,可能会导致催化剂失活
【解析】
(1)根据盖斯定律可知-反应Ⅰ-4×反应Ⅱ+2×反应Ⅲ即可得到CO2(g)+4H2(g)=CH4(g)+2H2O(g),据此计算ΔH;
(2)由图1可知CO2在催化剂铜的表面进行转化最终生成的产物是C2H4,根据发生的氧化还原反应确定传递的电子的量;
(3)①由图2可知,Cu与电源的负极相连,为阴极,阴极发生了还原反应;在阳极区OH-在被氧化生成O2;
②CO2与CH4在催化剂作用下发生化合反应生成乙酸;
(4)①由图3可知,当x=0.5时,CO2的转化率最大,催化效果最好,由此可确定金属杂多酸盐化学式;
②当处于过高的温度时,催化剂会失去催化活性。
(1)根据盖斯定律可知-反应Ⅰ-4×反应Ⅱ+2×反应Ⅲ即可得到CO2(g)+4H2(g)=CH4(g)+2H2O(g),ΔH=-(-890.3 kJ·mol-1)-4×(2.8 kJ·mol-1)+2×(-566.0 kJ·mol-1)=-252.9 kJ·mol-1;
(2)由图1可知CO2在催化剂铜的表面进行转化最终生成的产物是C2H4,根据发生的氧化还原反应可的关系:2CO2~C2H4~12e-,因此当有1 mol CO2反应时,直接传递的电子物质的量为6mol;
(3)①由图2可知,Cu与电源的负极相连,为阴极,阴极发生了还原反应,电极反应为:CO2+8e-+6H2O=CH4+8OH-;OH-在阳极被氧化生成O2,因此阳极区溶液的pH减小;
②CO2与CH4在催化剂作用下发生化合反应生成乙酸,反应方程式为:CH4+CO2![]() CH3COOH;
CH3COOH;
(4)①由图3可知,当x=0.5时,CO2的转化率最大,催化效果最好,因此金属杂多酸盐化学式为Co0.5H2PW12O40或CoH4P2W24O80;
②当处于过高的温度时,催化剂会失去催化活性,因此300 ℃催化效果远不如200 ℃和250 ℃。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如图1。
和CH3CH2CH2Br的方法如图1。
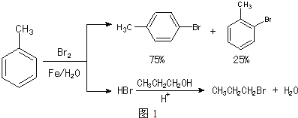
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入____,以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式___。
(2)反应装置如图3所示:
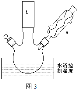
①图中玻璃仪器a的名称是____,方块b中为某玻璃仪器,其名称是___。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和____,加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是____。
(3)操作I的名称是___,操作Ⅲ的名称是___。