题目内容
【题目】以某含铜矿石[主要成分为FeCu4SiO5(OH)4,含少量SiO2、CuCO3]为原料,制备CuSO4·5H2O的流程如下:
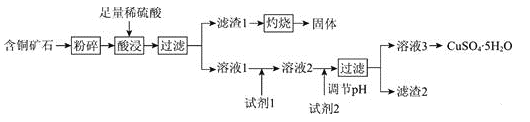
已知:
ⅰ.溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
ⅱ.相关试剂成分和价格如表1所示。
ⅲ.25℃时,该流程中金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表2所示。
表1
试剂 | 成分 | 价格/(元·吨-1) |
漂白液 | 含25.2%NaClO | 450 |
双氧水 | 含30%H2O2 | 2400 |
浓硝酸 | 含98%HNO3 | 1500 |
表2
氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.0 | 6.5 |
请回答:
(1)FeCu4SiO5(OH)4用氧化物的形式可表示为________。
(2)结合题中信息,所选用的试剂1的名称为________;加入该试剂时,所发生反应的离子方程式为________。
(3)加入试剂2,需调节溶液的pH的合理范围为________。试剂2可以选择下列物质中的________(填字母)。
A.Cu B.CuO
C.Cu(OH)2 D.Fe
(4)25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2]=________。
(5)CuSO4·5H2O溶液可用于电解精炼铜。电解精炼铜时,导线中通过9.632×104C的电量时,理论上阴极质量增加________g。(已知:1个电子的电量为1.6×10-19C)
【答案】 FeO·4CuO·SiO2·2H2O 漂白液 ClO-+2Fe2++2H+=Cl-+2Fe3++H2O 3.7≤pH<4.0 BC 1.0×10-20 32
【解析】试题分析:(1)FeCu4SiO5(OH)4用氧化物的形式表示时,先写活泼金属氧化物,再写不活泼金属氧化物,最后写非金属氧化物和水;(2)Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁。二氧化硅与稀硫酸不反应,所以滤液1中除含有Cu2+外,还含有的金属离子有Fe2+、Fe3+,为使溶液中铁元素沉淀析出,需要加氧化剂把Fe2+氧化为Fe3+,根据经济性、环境保护原则,选择漂白液做氧化剂;根据氧化还原反应规律配平方程式;(3)要让Fe3+完全沉淀,Cu2+不沉淀,根据金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH表选择合适PH;选择试剂2,要依据不引入新杂质的原则;(4)根据铜离子浓度为1.0×10-5mol·L-1,溶液PH为6.5,计算25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2];(5)先根据电量计算电子的物质的量,再根据阴极反应![]() 计算生成铜的质量。
计算生成铜的质量。
解析:根据元素分析,(1)FeCu4SiO5(OH)4用氧化物的形式可表示为FeO·4CuO·SiO2·2H2O;(2)加入试剂1的目的是把Fe2+氧化为Fe3+,根据经济性、环境保护原则,选择漂液做氧化剂;反应离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O;(3)要让Fe3+完全沉淀, PH![]() 3.7,Cu2+不沉淀,PH<4.0,所以PH的合理范围为3.7≤pH<4.0;不引入新杂质,试剂2为CuO、Cu(OH)2;(4)Ksp[Cu(OH)2]= c(Cu2+)×c2(OH)2=1.0×10-5mol·L-1×(1.0×10-7.5 mol·L-1)2= 1.0×10-20;(5)电路中转移电子的物质的量为
3.7,Cu2+不沉淀,PH<4.0,所以PH的合理范围为3.7≤pH<4.0;不引入新杂质,试剂2为CuO、Cu(OH)2;(4)Ksp[Cu(OH)2]= c(Cu2+)×c2(OH)2=1.0×10-5mol·L-1×(1.0×10-7.5 mol·L-1)2= 1.0×10-20;(5)电路中转移电子的物质的量为![]() 1mol,根据
1mol,根据![]() ,生成铜的物质的量为0.5 mol,质量为32 g,理论上阴极质量增加32 g。
,生成铜的物质的量为0.5 mol,质量为32 g,理论上阴极质量增加32 g。

