题目内容
【题目】下列说法正确的是
A. 久置的漂白粉漂白效果更好
B. 以海水为原料能提取出Na、Mg、Br2等物质
C. 次氯酸和二氧化硫的漂白原理相同
D. 二氧化硅不与任何酸反应,可用石英制造耐酸容器
【答案】B
【解析】A.久置的漂白粉在放置的过程中,吸收空气中的CO2,Ca(ClO)2转化为碳酸钙和HClO,HClO分解后漂白效果降低,故A错误;B.海水中富含Na、Mg及Br元素,则海水为原料能提取出Na、Mg、Br2等物质,故B正确;C.次氯酸是利用强氧化性漂白,二氧化硫是其与有色物质生成无色物质,二者漂白原理不相同,故C错误;D.二氧化硅能与HF反应,故D错误;答案为B。

【题目】以某含铜矿石[主要成分为FeCu4SiO5(OH)4,含少量SiO2、CuCO3]为原料,制备CuSO4·5H2O的流程如下:
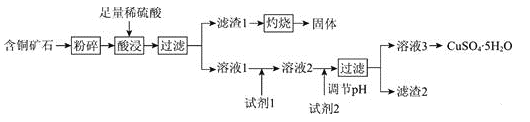
已知:
ⅰ.溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
ⅱ.相关试剂成分和价格如表1所示。
ⅲ.25℃时,该流程中金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表2所示。
表1
试剂 | 成分 | 价格/(元·吨-1) |
漂白液 | 含25.2%NaClO | 450 |
双氧水 | 含30%H2O2 | 2400 |
浓硝酸 | 含98%HNO3 | 1500 |
表2
氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.0 | 6.5 |
请回答:
(1)FeCu4SiO5(OH)4用氧化物的形式可表示为________。
(2)结合题中信息,所选用的试剂1的名称为________;加入该试剂时,所发生反应的离子方程式为________。
(3)加入试剂2,需调节溶液的pH的合理范围为________。试剂2可以选择下列物质中的________(填字母)。
A.Cu B.CuO
C.Cu(OH)2 D.Fe
(4)25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2]=________。
(5)CuSO4·5H2O溶液可用于电解精炼铜。电解精炼铜时,导线中通过9.632×104C的电量时,理论上阴极质量增加________g。(已知:1个电子的电量为1.6×10-19C)