题目内容
【题目】钠离子二次电池工作时的总反应式为:![]() ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是
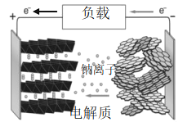
A.钠离子电池的负极是Na-C复合材料
B.电池工作时电流从正极流出,经过负载流到负极,再经电解质流回正极
C.电解质可以是含Na+的导电有机聚合物或能传导Na+的固体钠盐
D.电池正极的电极反应式为:![]()
【答案】D
【解析】
A、由总反应式为:![]() 可看出电池放电时钠失去电子被氧化,所以负极有钠,图中显示钠是嵌入石墨层间的,选项A正确;
可看出电池放电时钠失去电子被氧化,所以负极有钠,图中显示钠是嵌入石墨层间的,选项A正确;
B、在外电路,通过电子导电,电流与电子流向相反应,内电路则通过Na+的迁移导电,因此电流方向就是Na+移动的方向,形成一个闭合回路,选项B正确;
C、金属钠非常活泼,可以判断电池内电解质一般不是水溶液,选项C正确;
D、根据图可判断电池正极的电极反应是得到Na+,因此变化相反,选项D不正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
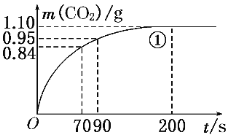
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。