题目内容
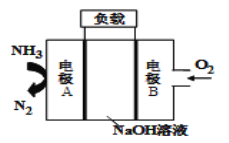
【题目】利用海水提取溴和镁的过程如下,下列说法不正确的是
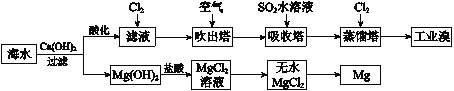
A. 工业溴中含少量Cl2,可用NaOH溶液除去
B. 工业上常利用电解熔融MgCl2冶炼金属镁
C. 富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D. 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2
【答案】A
【解析】试题A.由于Br2能与NaOH溶液反应,因此用NaOH溶液吸收Cl2的同时,Br2也被吸收,A错误;B.工业上常用电解熔融的MgCl2冶炼金属镁,B正确;C.溴易挥发,因此在富集溴元素的过程中,可以使用空气吹出法,C正确;D.溶液酸化之后得到的滤液中Br-与氯气发生反应,生成1molBr2,需要1molCl2,然后1molBr2在吹出塔富集,并在吸收塔中被SO2还原成2molBr-,然后在蒸馏塔中Cl2再次将2molBr-氧化成1molBr2,因此整个过程若提取1molBr2,至少需要标准状况下44.8 L的Cl2。答案选A。

练习册系列答案
相关题目