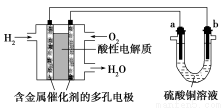
题目内容
如图所示,在不同的电解质溶液中可以组成不同的电池。
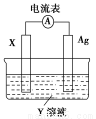
(1)①当电解质溶液为稀硫酸时,Fe电极是 (填“正”或“负”)极,其电极反应式为
。
②当电解质溶液为NaOH溶液时,Al电极是 (填“正”或“负”)极,其电极反应式为 。
(2)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是 (填“正”或“负”)极,其电极反应式为 。
(1)①正 2H++2e-=H2↑
②负 Al-3e-+4OH-=AlO2-+2H2O
(2)正 NO3-+2H++e-=NO2↑+H2O
【解析】(1)①电解质溶液是稀硫酸时,Al电极是负极,Fe电极是正极,正极反应式为2H++2e-=H2↑。②当电解质溶液是NaOH溶液时,铝与NaOH溶液反应,而Fe不反应,故铝作原电池的负极,电极反应式为Al-3e-+4OH-=AlO2-+2H2O。(2)把铝改为锌,用浓硝酸作电解质溶液,铁遇浓硝酸发生钝化,则Fe电极是正极,Zn电极是负极,Fe电极上的电极反应式为NO3-+2H++e-=NO2↑+H2O。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目