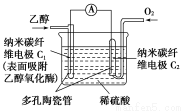
题目内容
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
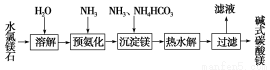
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)= 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”)。
(1)2.0 mol·L-1
(2)NH4Cl
(3)n(CO2)= =4.00×10-2 mol
=4.00×10-2 mol
n(MgO)= =5.00×10-2 mol
=5.00×10-2 mol
n(H2O)= =5.00×10-2 mol
=5.00×10-2 mol
n(MgO)∶n(CO2)∶n(H2O)=5.00×10-2∶4.00×10-2∶5.00×10-2=5∶4∶5
碱式碳酸镁的化学式为Mg(OH)2·4MgCO3·4H2O
(4)升高
【解析】(1)Ksp=c(Mg2+)·c2(OH-),则c(Mg2+)= =
= =2.0 (mol·L-1)。
=2.0 (mol·L-1)。
(2)滤液中的溶质主要成分为NH4Cl,可根据元素守恒解答该题。
(4)Mg(OH)2·4MgCO3·4H2O中Mg的质量分数为: ×100%=25.75%,MgCO3中Mg的质量分数为:
×100%=25.75%,MgCO3中Mg的质量分数为: ×100%=28.57%,所以产品中混有MgCO3,则Mg的质量分数升高。
×100%=28.57%,所以产品中混有MgCO3,则Mg的质量分数升高。

一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)  SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
反应时间/min | n(SiF4)/mol | n(H2O)/mol |
0 | 1.20 | 2.40 |
t1 | 0.80 | a |
t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大