题目内容
【题目】目前,处理烟气中SO2常采用两种方法:液吸法和还原法。
Ⅰ.碱液吸收法
25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。第1步:用过量的浓氨水吸收SO2,并在空气中氧化;第2步:加入石灰水,发生反应Ca2++2OH-+2NH4+ +SO42-![]() CaSO4↓+2NH3·H2O K。
CaSO4↓+2NH3·H2O K。
(1)25 ℃时,0.1 mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)计算第2步中反应的K=___________。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)![]() S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
(3)表示液态硫(S)的燃烧热的热化学方程式为_____________。
(4)反应②中,正反应活化能E1____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[![]() =y]、温度T的关系如图所示。
=y]、温度T的关系如图所示。

比较平衡时CO的转化率α(CO):N____(填“>”“<”或“=”,下同)M。逆反应速率:N___P。
(6)某温度下,向10 L恒容密闭容器中充入2 mol H2、2 mol CO和2 mol SO2发生反应①、②,第5 min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为________。
②其他条件不变,在第7 min时缩小容器体积,α(SO2)______(填“增大”“减小”或“不变”)。
【答案】> 4.3×1013 S(l)+O2(g)=SO2(g) ΔH=-529kJ/mol > > < 2700 增大
【解析】
(1)由于Kb(NH3H2O)=1.8×10-5>Ka2(H2SO3)=1.0×10-7,由盐的水解规律:“谁弱谁水解,谁强显谁性”可知,(NH4)2SO3溶液呈碱性,pH>7;
(2)第2步:加入石灰水,发生反应Ca2++2OH-+2NH4+ +SO42-![]() CaSO4↓+2NH3·H2O 化学平衡常数K=
CaSO4↓+2NH3·H2O 化学平衡常数K=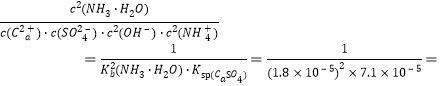 4.3×1013;
4.3×1013;
(3)①2CO(g)+SO2(g)![]() S(l)+2CO2(g)△H1=-37.0kJ/mol,
S(l)+2CO2(g)△H1=-37.0kJ/mol,
②2H2(g)+SO2(g)=S(l)+2H2O(g) △H2=+45.4kJ/mol,
CO的燃烧热△H3=-283kJ/mol,即③CO(g)+![]() O2(g)=CO2(g) △H3=-283kJ/mol,③×2-①,S(l)+O2(g)=SO2(g) △H=2△H3-△H1=-529kJ/mol;
O2(g)=CO2(g) △H3=-283kJ/mol,③×2-①,S(l)+O2(g)=SO2(g) △H=2△H3-△H1=-529kJ/mol;
(4)反应②的正反应为吸热反应,正反应活化能E1-E2=ΔH2>0,E1=E2+ΔH2,由于E2>0,所以E1>ΔH2;
(5)分析图象,当控制物料比相同时,T1温度下的转化率高于T2温度下的转化率,考虑到反应是吸热反应,温度升高有利于提高反应物的转化率,则温度关系应为:T1>T2;
①N点和M点时SO2的转化率相同,温度M点高于N点,升高温度有利于提高转化率,同时对于反应①来说,增加其中一种反应物的量可使另一反应物的转化率提高,而该物质本身的转化率降低,转化率已经可以由温度控制,为使二者SO2转化率相等,则需要控制N点CO的量少于M点CO的量,则转化率:N>M;
②温度T1>T2,温度越高,化学反应速率越大,则逆反应速率:N<P;
(6)① 对于2CO(g)+SO2(g)![]() S(l)+2CO2(g)
S(l)+2CO2(g)
c(开始) 0.2 0.2 0
c(平衡) 0.04 0.12 0.16
对于反应2H2(g)+SO2(g)![]() S(l)+2H2O(g)
S(l)+2H2O(g)
c(开始) 0.2 0.12 0
c(平衡) 0.02 0.03 0.18
所以反应②的化学平衡常数K=![]()
②其他条件不变,在第7 min时缩小容器体积,也就使容器的压强增大,由于两个反应的正反应都是气体体积减小的反应,所以缩小体积,容器的压强增大,化学平衡正向移动,α(SO2)增大。