题目内容
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
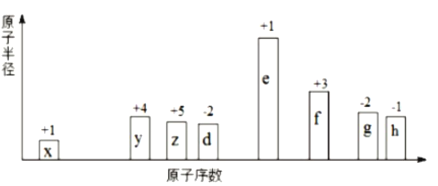
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______。
A. N2和H2在一定条件下反应生成NH3
B. 雷雨闪电时空气中的N2和O2化合生成NO
C. NH3经过催化氧化生成NO
D. NH3和HNO3反应生成NH4NO3
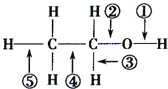
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
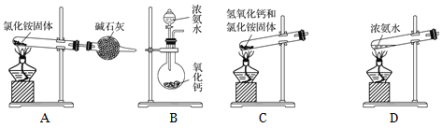
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
(7) 收集氨气应使用________法,要得到干燥的氨气可选用_________做干燥剂。
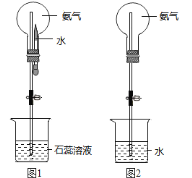
(8)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(9)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(10)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
【答案】![]() D
D ![]() A
A ![]() Ca(OH)2+2NH4Cl
Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O AC 向上排空气法 碱石灰 NH3H2O
CaCl2+2NH3↑+2H2O AC 向上排空气法 碱石灰 NH3H2O![]() NH4++OH- 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体
NH4++OH- 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体
【解析】
(1)N原子核外有7个电子,根据核外电子排布书写N原子结构示意图;
(2)N2是双原子分子,2个N原子共用三对电子,要参加化学反应首先要变为N原子;据此分析解答;
(3)N原子最外层有5个电子,2个N原子共用三对电子,形成共价三键;根据氮的固定的含义分析、判断;
(4)N原子与三个H原子形成3个共价键,结合形成NH3;
(5)消石灰与氯化铵固体混合加热产生氨气、氯化钙和水;
(6)A.氯化铵不稳定受热易分解,但是NH3与HCl遇冷又极易反应生成NH4Cl固体;
B.CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
C.固体加热制气体时,试管口应略向下倾斜;
D.浓氨水易挥发,加热能够促进氨气的逸出;
(7)氨气是碱性气体,密度比空气小,极容易溶于水;
(8)利用氨气极易溶于水,形成压强差而形成喷泉,氨水显碱性,使石蕊试液变为红色;
(9)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时会导致烧瓶内压强减小;
(10)NH4NO3不稳定,受热分解产生氨气和硝酸;检验NH4+的方法可根据铵盐与碱共热产生氨气,氨气是碱性气体,能够使湿润的红色石蕊试纸变为蓝色。
(1)N原子核外有7个电子,核外电子排布是2、5,则N原子结构示意图为:![]() ;
;
(2)A.氮分子是双原子分子,但双原子分子组成的物质可能活泼,如Cl2,N2不容易反应与是否是双原子分子无关,A错误;
B.氮元素的非金属性很强,原子获得电子能力强,氮气要参加反应,首先应该变为单个原子,因此不能证明氮气性质不活泼,B错误;
C.氮原子的半径较小,原子获得电子能力强,与氮气性质不活泼无关,C错误;
D.N2是双原子分子,2个N原子共用三对电子,断裂N≡N需要消耗很高的能量,因此氮气不容易参加化学反应,D正确;
故合理选项是D;
(3)N2分子中2个N原子形成3个共价键,使每个N原子都达到稳定结构,所以N2的电子式:![]() ;将空气中的氮气转化为氮的化合物的过程称为固氮。
;将空气中的氮气转化为氮的化合物的过程称为固氮。
A. N2和H2在一定条件下反应生成NH3,氮元素的单质变为化合物,属于人工固氮,A正确;
B.雷雨闪电时空气中的N2和O2化合生成NO,氮元素的单质变为化合物,属于氮的固定,是自然固氮,B错误;
C. NH3经过催化氧化生成NO,是N元素的化合物的转化,不是氮的固定,C错误;
D.NH3和HNO3反应生成NH4NO3,是N元素的化合物的转化,不是氮的固定,D错误;
因此合理选项是A;
(4)在NH3中,N原子最外层有5个电子,N原子与三个H原子形成3个共价键,从而使每个原子都达到稳定结构,NH3的电子式:结合形成NH3,所以NH3的电子式为![]() ;
;
(5)消石灰与氯化铵固体混合加热产生氨气、氯化钙和水,此反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(6)A.氯化铵不稳定受热易分解,但是氨气与氯化氢遇冷又极易反应生成氯化铵固体,不能用于制备氨气,A错误;
B.向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,有利于浓氨水中的氨气逸出,B正确;
C.固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,所以利用氯化铵和氢氧化钙固体加热制取氨气需试管口应略向下倾斜,C错误;
D.浓氨水易挥发,加热能够促进氨气的逸出,可以用来制备氨气,D正;
故合理选项是AC;
(7)密度比空气小,极容易溶于水,因此收集氨气可用向下排空气方法;氨气是碱性气体,因此干燥氨气要用碱性干燥剂碱石灰等干燥;
(8)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,当挤压滴管的胶头时,水进入烧瓶中,氨气溶于水,使烧瓶内气体压强减小,烧杯内的水不断进入烧瓶,由于氨气溶于水形成的一水合氨电离产生NH4+、OH-,水溶液显碱性,因此可以得到红色喷泉,用方程式表示为:NH3H2O![]() NH4++OH-;
NH4++OH-;
(9)如果只提供如图2的装置,引发喷泉的方法是打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉;
(10)NH4NO3是常用的铵态氮肥,在施用时若受热,就会发生分解反应释放出氨气而降低肥效。检验NH4+的方法是加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数