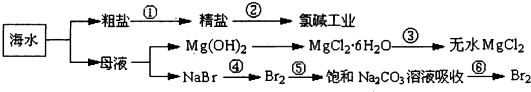
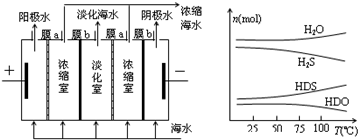
题目内容
工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
(1)反应CH3OH(1)=CO(g)+2H2(g)的△H=__________kJ/mol。
(2)标准状况下33.6LCO、H2的混合气体与足量氧气充芬反应后,将生成的CO2和水蒸气通入足量的Na2O2后,固体质量增加30.0g,则CO、H2的混合气体的平均相对分子质量为____________________________。
(3)利用反应H2(g)+CO(g)+O2(g)=H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池,已知该该电池使用KOH溶液作电解质溶液,则正极的电极反应式为_____________。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,则该电解总反应的离子方程式是________________。若电解100mL0.1mol/L的NaCl溶液,阴、阳两极各产生112mL气体(标准状况下),则所得溶液的pH为___________(忽略反应前后溶液的体积变化);若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生672mL气体(标准状况下)时,阴极析出的固体质量为____________g。
 CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:(1)反应CH3OH(1)=CO(g)+2H2(g)的△H=__________kJ/mol。
(2)标准状况下33.6LCO、H2的混合气体与足量氧气充芬反应后,将生成的CO2和水蒸气通入足量的Na2O2后,固体质量增加30.0g,则CO、H2的混合气体的平均相对分子质量为____________________________。
(3)利用反应H2(g)+CO(g)+O2(g)=H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池,已知该该电池使用KOH溶液作电解质溶液,则正极的电极反应式为_____________。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,则该电解总反应的离子方程式是________________。若电解100mL0.1mol/L的NaCl溶液,阴、阳两极各产生112mL气体(标准状况下),则所得溶液的pH为___________(忽略反应前后溶液的体积变化);若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生672mL气体(标准状况下)时,阴极析出的固体质量为____________g。
(1)+128.1
(2)20.0
(3)O2+2H2O+ 4e-=4OH-;2Cl-+2H2O Cl2↑+H2↑+2OH-;13;2.56
Cl2↑+H2↑+2OH-;13;2.56

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目