题目内容
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示: 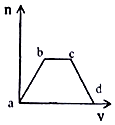
(1)ab段发生的离子反应方程式为 .
(2)bc段依次发生两个离子反应,首先是 , 其次是 .
(3)cd段发生的离子反应方程式是 .
【答案】
(1)CO2+2OH﹣+Ca2+=CaCO3↓+H2O
(2)CO2+2OH﹣=CO32﹣+H2O;CO2+CO32﹣+H2O=2HCO3﹣
(3)CO2+H2O+CaCO3=Ca2++2HCO3﹣
【解析】解:(1)ab段氢氧化钙优先与二氧化碳反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2+2OH﹣+Ca2+=CaCO3↓+H2O,故答案为:CO2+2OH﹣+Ca2+=CaCO3↓+H2O;(2)bc段KOH与二氧化碳反应生成碳酸钾,碳酸钾与二氧化碳反应生成碳酸氢钾,反应的离子方程式为:CO2+2OH﹣=CO32﹣+H2O、CO2+CO32﹣+H2O=2HCO3﹣ ,
故答案为:CO2+2OH﹣=CO32﹣+H2O;CO2+CO32﹣+H2O=2HCO3﹣;(3)cd段沉淀逐渐减少,说明碳酸钙与二氧化碳反应生成碳酸氢钙,反应的离子方程式为:CO2+H2O+CaCO3=Ca2++2HCO3﹣ ,
故答案为:CO2+H2O+CaCO3=Ca2++2HCO3﹣ .
向KOH和Ca(OH)2的混合稀溶液中通入CO2 , 氢氧化钙优先反应(ab段),反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O;然后KOH与二氧化碳反应(bc段):2KOH+CO2═K2CO3、K2CO3+H2O+CO2═2KHCO3;最后碳酸钙沉淀溶解(cd):CaCO3+H2O+CO2═Ca(HCO3)2 , 据此书写反应的离子方程式.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案