题目内容
19.下列各组顺序的排列不正确的是( )| A. | 酸性强弱:H4SiO4>H3PO4>H2SO4 | B. | 还原性:Na>Mg>Al | ||
| C. | 热稳定性:SiH4<PH3<H2S<HCl | D. | 熔点:SiO2>NaCl>I2>CO2 |
分析 A.同周期元素的原子从左到右非金属性增强,非金属性越强,最高价氧化物的水化物酸性越强;
B.同周期从左向右金属性减弱;
C.非金属性越强,气态氢化物越稳定性;
D.一般来说,原子晶体的熔点>离子晶体>分子晶体,分子晶体中相对分子质量大的熔点高.
解答 解:A.非金属性为Si<P<S,则酸性为H4SiO4<H3PO4<H2SO4,故A错误;
B.同周期从左向右金属性减弱,失去电子能力减弱,则还原性:Na>Mg>Al,故B正确;
C.非金属性为Si<P<S<Cl,热稳定性:SiH4<PH3<H2S<HCl,故C正确;
D.一般来说,原子晶体的熔点>离子晶体>分子晶体,分子晶体中相对分子质量大的熔点高,则熔点:SiO2>NaCl>I2>CO2,故D正确;
故选A.
点评 本题考查性质的比较,为高频考点,把握元素周期律和元素周期表为解答的关键,侧重规律性知识及分析、应用能力的考查,题目难度不大.

练习册系列答案
相关题目
9.若40g密度为P g•Cm-3cm的硝酸钙溶液里含1g Ca2+,则NO3-的物质的量浓度是( )
| A. | p/400 mol•L-1 | B. | 20 p mol•L-1 | C. | 1.25 p mol•L-1 | D. | 2.5 p mol••L-1 |
10.下列事实能用勒夏特列原理解释的是( )
| A. | 硫酸氢钠溶液的pH值小于7 | |
| B. | 久制的氨水pH值变小 | |
| C. | 合成氨工厂通常采用500℃高温,以提高原料的利用率 | |
| D. | 过氧化氢分解加氯化铁溶液作催化剂,使单位时间内产生的氧气的量多 |
7.在5L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c(H{\;}_{2}O)}{c(CO{\;}_{2})×c({H}_{2})}$.
(2)该反应的△H>(填“>”或“<”)0.
(3)某温度下,该反应平衡时各物质的浓度关系为:3[c(CO2)•c(H2)]=5[c(CO)•c(H2O)],则反应温度是700℃.
(4)将CO2和H2各0.05mol充入该容器中,某温度下达到平衡状态,测得c(CO)=0.008mol/L,则CO2的转化率为80%.
(5)若容器容积不变,温度不变,平衡后向容器内继续充入CO2,则H2的转化率变大,CO2的转化率变小(填“变大”“变小”或“不变”).
(6)该反应达到平衡后,只改变一个条件,平衡向逆反应方向移动的是ad.
a.降低温度 b.保持压强不变,充入N2 c.保持容器容积不变,充入N2 d.保持容器容积不变,加入NaOH溶液.
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应的△H>(填“>”或“<”)0.
(3)某温度下,该反应平衡时各物质的浓度关系为:3[c(CO2)•c(H2)]=5[c(CO)•c(H2O)],则反应温度是700℃.
(4)将CO2和H2各0.05mol充入该容器中,某温度下达到平衡状态,测得c(CO)=0.008mol/L,则CO2的转化率为80%.
(5)若容器容积不变,温度不变,平衡后向容器内继续充入CO2,则H2的转化率变大,CO2的转化率变小(填“变大”“变小”或“不变”).
(6)该反应达到平衡后,只改变一个条件,平衡向逆反应方向移动的是ad.
a.降低温度 b.保持压强不变,充入N2 c.保持容器容积不变,充入N2 d.保持容器容积不变,加入NaOH溶液.
4.如表是元素周期表的一部分,针对表中的①~⑩十种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:氩(填元素名称).元素⑨在周期表中的位置为第四周期第IA族.
(2)①②③三种元素形成的气态氢化物中,最稳定的是H2O(填化学式),④⑤⑨三种元素最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)③④⑤⑥四种元素形成的简单离子,离子半径由大到小的顺序是S2->O2->Na+>Al3+.(用离子符号表示)
(4)元素①和③形成的三原子化合物的结构式为:O=C=O,元素②的氢化物的电子式为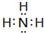 ,写出实验室制取该氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.
,写出实验室制取该氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.
(5)元素④与⑥形成的化合物属于离子(填“离子”、“分子”或“原子”)晶体,用电子式表示该化合物的形成过程: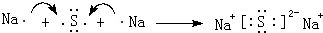 .
.
(6)用一个化学方程式说明⑥和⑦的非金属性相对强弱:Cl2+H2S=2HCl+S↓或Cl2+Na2S=2NaCl+S↓.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)①②③三种元素形成的气态氢化物中,最稳定的是H2O(填化学式),④⑤⑨三种元素最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)③④⑤⑥四种元素形成的简单离子,离子半径由大到小的顺序是S2->O2->Na+>Al3+.(用离子符号表示)
(4)元素①和③形成的三原子化合物的结构式为:O=C=O,元素②的氢化物的电子式为
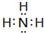 ,写出实验室制取该氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.
,写出实验室制取该氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.(5)元素④与⑥形成的化合物属于离子(填“离子”、“分子”或“原子”)晶体,用电子式表示该化合物的形成过程:
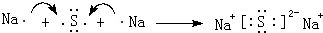 .
.(6)用一个化学方程式说明⑥和⑦的非金属性相对强弱:Cl2+H2S=2HCl+S↓或Cl2+Na2S=2NaCl+S↓.
11.氯气在加热情况下分别与铁、磷充分反应,产物是( )
| A. | FeCl2、PCl3 | B. | FeCl3、PCl3 | C. | FeCl3、PCl5 | D. | FeCl2、PCl5 |
8.下列变化中需要加入还原剂才能实现的是( )
| A. | 亚硫酸钠→二氧化硫 | B. | 氯气→氯离子 | ||
| C. | 硝酸→二氧化氮 | D. | 二氧化硫→硫单质 |
5.能在无色的酸性溶液中大量共存的是下列各组中的离子,( )
| A. | Mg2+、SO42-、K+ | B. | ClO -、Na+、Cl- | C. | Cu2+、NO3-、NH4 + | D. | Ag+、NO3-、I- |