题目内容
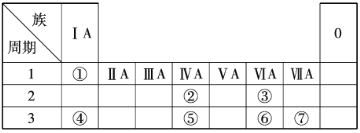
【题目】元素①~⑦在周期表中的相对位置如图所示。
请回答下列问题。
(1)⑤的元素符号是____________,其最高正化合价是____________。
(2)①~⑦中金属性最强的是____________(填元素符号),能证明⑥比②的非金属性强的事实是____。
(3)③④形成的化合物是____________或____________。
(4)④⑥⑦原子半径由大到小的顺序是__________________(用元素符号表示);④的最高价氧化物对应的水化物是____________,它与⑥的最高价氧化物对应的水化物反应的离子方程式是__________________。
【答案】![]()
![]()
![]()
![]() 为强酸、
为强酸、![]() 为弱酸(其他合理答案也可)
为弱酸(其他合理答案也可) ![]()
![]()
![]() NaOH
NaOH 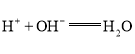
【解析】
由元素在周期表中的位置,可知①为![]() 、②为
、②为![]() 、③为
、③为![]() 、④为
、④为![]() 、⑤为
、⑤为![]() 、⑥为
、⑥为![]() 、⑦为
、⑦为![]() ,据此分析。
,据此分析。
由元素在周期表中的位置,可知①为![]() 、②为
、②为![]() 、③为
、③为![]() 、④为
、④为![]() 、⑤为
、⑤为![]() 、⑥为
、⑥为![]() 、⑦为
、⑦为![]() ;
;
(1)⑤的元素符号为![]() ,硅的最外层有4个电子,其最高正化合价为
,硅的最外层有4个电子,其最高正化合价为![]() ;
;
(2)①~⑦中金属性最强的是![]() 元素;⑥为
元素;⑥为![]() 、②为
、②为![]() ,由于
,由于![]() 为强酸、
为强酸、![]() 为弱酸,则
为弱酸,则![]() 的非金属性比
的非金属性比![]() 强;
强;
(3)③④分别为![]() 、
、![]() 元素,二者形成的化合物为
元素,二者形成的化合物为![]() 、
、![]() ;
;
(4)![]() 、
、![]() 和
和![]() 位于同一周期,从左到右原子半径逐渐减小,则原子半径大小为
位于同一周期,从左到右原子半径逐渐减小,则原子半径大小为![]() ;④为
;④为![]() ,其最高价氧化物对应的水化物是
,其最高价氧化物对应的水化物是![]() ;⑥的最高价氧化物对应的水化物为
;⑥的最高价氧化物对应的水化物为![]() ,硫酸与氢氧化钠反应生成硫酸钠和水,反应的离子方程式为
,硫酸与氢氧化钠反应生成硫酸钠和水,反应的离子方程式为 。
。

练习册系列答案
相关题目
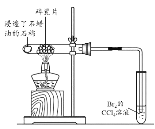
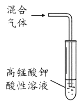
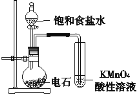
【题目】下列实验方案中,能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 分离甲烷和氯气发生反应后得到的液态混合物 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 制备并检验乙炔的性质 |
A.AB.BC.CD.D