题目内容
【题目】某研究性学习小组欲测定室温下(25℃,101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
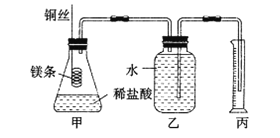
该实验的主要操作步骤如下:
①配制 100 mL 1.0mol/L的盐酸溶液:.
②用_______________(填仪器名称并注明规格)量取7.5mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝未端,为使HCl全部参加反应,a的数值至少为__________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为91.9mL
请将上述步骤补充完整并回答下列问题。
(1)步骤①中所需要带刻度的仪器为__________,若用36.5%的浓盐酸(密度为1.20g/mL)
进行稀释配制,则需要量取该浓盐酸___________mL
(2)步骤①中,配制100 mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低___________(填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液.
C.未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后;发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线.
F.烧杯中有少量水.
(3)请填写操作步骤中的空格:步骤②_________步骤③_______________
(4)实验步骤5中应选用______________(填字母)的量筒。.'
A.100 mL B.200mL C.500mL
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=_____________L/mol(保留2位小数)
【答案】10mL量筒 0.09g 量筒 8.3mL AC 10mL量筒 0.09g A 24.51mol/L
【解析】
(1)步骤①配制过程中所需要的玻璃仪器有量筒、烧杯、100 mL容量瓶、胶头滴管、玻璃棒,其中需要带刻度的仪器为量筒;
36.5%的浓盐酸(密度为1.20g/mL)的物质的量浓度c=![]() =
=![]() =12mol/L,溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀)计算,设需浓盐酸VL,0.10L×1.0mol/L=12.0mol/L×VL;V=0.0083L=8.3mL;
=12mol/L,溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀)计算,设需浓盐酸VL,0.10L×1.0mol/L=12.0mol/L×VL;V=0.0083L=8.3mL;
(2)A.用量筒量取浓盐酸时,俯视量筒的刻度会使所量取溶液的体积减小,时所配置的溶液的浓度偏小,选项A符合;
B.容量瓶未干燥即用来配制溶液对所配置的溶液的浓度没有影响,选项B不符合;
C.未洗涤烧杯和玻璃棒,则n偏小,会使配制浓度偏低,选项C符合;
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线不会对所配置的溶液的浓度有影响,选项D不符合;
E.在容量瓶中定容时俯视容量瓶刻度线,会使容量瓶中的液体的体积偏小,所配置的溶液浓度偏大,选项E不符合;
F.烧杯中有少量水对配置的溶液的浓度无关,选项F不符合;
故答案为AC;
(3)步骤②量取7.5mL 1.0mol/L的盐酸溶液加入锥形瓶中,题中要求酸的体积7.5mL,故选用10mL量筒即可;
步骤③
Mg+2HCl═MgCl2+H2↑
1mol 2mol
n 0.0075 mol
n=0.00375mol,故a=24g/mol×0.00375mol=0.090g;
故答案为:10mL量筒;0.09g;
(4)Mg+2HCl═MgCl2+H2↑
2mol 1mol
0.0075 mol n(H2)
n(H2)=0.00375mol,V(H2)=0.00375 mol×22.4L/mol=0.056L=56ml,应选100mL量筒;
故答案为:A;
(5)由步骤③得气体的物质的量为0.00375mol,气体的体积为91.9mL mL,Vm=![]() =
=![]() =24.51L/mol;
=24.51L/mol;
故答案为:24.51mol/L。

 计算高手系列答案
计算高手系列答案【题目】下列内容与结论相对应的是
选项 | 内容 | 结论 |
A | H2O(g)变成H2O(l) | △S>0 |
B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
D | H2(g)+F2(g)=2HF(g),△H=-271kJ/mol △S=8J/(mol·K) | 反应在任意外界条件下均可自发进行 |
A. A B. B C. C D. D