题目内容
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
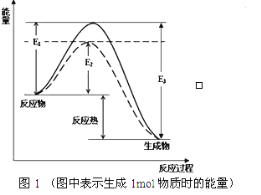
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
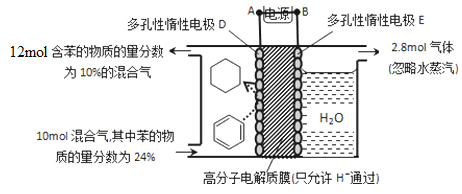
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
【答案】⑴N2(g)+3H2g)![]() 2NH3(g) △H=2(E1-E3)kJ·L-1(2分)
2NH3(g) △H=2(E1-E3)kJ·L-1(2分)
(2)4NA或2.408×1024 (2分)
(3)LiNH2(2分) 11.4 (2分)
(4)FePO4+ Li ++e-=LiFePO4 (2分)
(5)①A→D (2分)②C6H6+6H++6e-=C6H12 (2分)③64.3%
【解析】
试题分析:(1)反应物的总能量高于生成物总能量,反应是放热反应,反应的热化学方程式为N2(g)+3H2g)![]() 2NH3(g) △H=2(E1-E3)kJ·L-1。
2NH3(g) △H=2(E1-E3)kJ·L-1。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,反应前后Al元素的化合价不变,则反应前后Al元素的化合价均是+3价,因此反应前LiAlH4中氢元素的化合价是-1价,水中氢元素的化合价是+1价,LiAlH4中氢元素的化合价从-1价升高到0价,因此该反应消耗1mol LiAlH4时转移的电子数目为4NA或2.408×1024。
(3)氢气中氢元素的化合价部分升高到+1价,部分降低到-1价,所以氧化产物为LiNH2;该反应中,反应掉2mol氢气,同时消耗1mol氮化锂,所以储存氢气最多可达Li3N质量的:4/35×100%≈11.4%;
(4)已知电池放电时总反应式为FePO4+Li═LiFePO4,因此电池正极反应为FePO4+ Li ++e-=LiFePO4;
(5)①苯生成环戊烷属于得氢反应,因此是还原反应,即电极D是阴极,电极E是阳极,因此导线中电子的流动方向是A→D。②苯得到电子生成环戊烷是目标产物,由于存在质子交换膜,所以氢离子向阴极移动,则电极反应式为C6H6+6H++6e-=C6H12。③阳极生成2.8mol气体,该气体应该是阳极OH-放电生成的氧气,则转移电子的物质的量=2.8mol×4=11.2mol。反应前苯是2.4mol,反应后苯是1.2mol,则消耗苯是1.2mol,根据电极反应式C6H6+6H++6e-=C6H12可知得到电子是7.2mol,因此储氢装置的电流效率=![]() ×100%=64.3%。
×100%=64.3%。