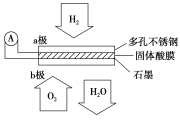
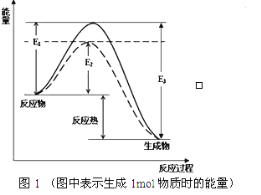
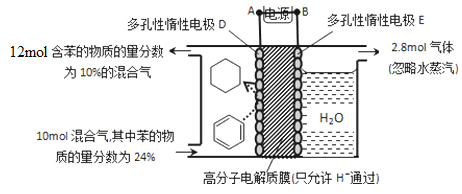
题目内容
【题目】某硅酸锌样品含58.6%的锌,而ZnO%与SiO2%的质量分数的总和为100%,写出这样品的化学式(最简式)。
【答案】23.2ZnO·SiO2
【解析】
试题分析:因为硅酸锌样品中含58.6%的锌,所以氧化锌的质量分数为58.6%÷[65/(65+16)] =73.0%,因为ZnO%与SiO2%的质量分数的总和为100%,所以SiO2%=1-73.0%=27.0%,则ZnO:SiO2=(73.0÷81):(27.0÷60)=2:1,该硅酸锌样品的化学式为:2ZnO·SiO2。

练习册系列答案
相关题目