题目内容
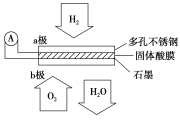
【题目】(探究题)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的,一段时间后,甲中溶液颜色,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明_________________在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(3)现用丙装置给铜件镀银,则H应是__________,电镀液是__________溶液。
(4)若将C电极换为铁,其他装置都不变,则甲中发生的总反应的离子方程式为:________________。
【答案】(1)负极,变浅,胶粒;(2)1:2:2:2;
(3)铜,AgNO3;(4)Fe+Cu2+=Fe2++Cu。
【解析】
试题分析:(1)乙池电解饱和NaCl溶液,F极变红,说明产生OH-,2H2O + 2e- = H2↑ +2OH- ,F电极为阳极,因此B为正极,A为负极,C为阳极,D为阴极,阳极反应式为:4OH--4e-=2H2O+O2↑,阴极电极反应式:Cu2++2e-=Cu,溶液中Cu2+浓度减小溶液变浅,Fe(OH)3胶粒带正电,胶粒向阴极移动;(2)C极阳极反应式为:4OH--4e-=2H2O+O2↑,D极阴极电极反应式:Cu2++2e-=Cu,E电极反应式:2Cl--2e-=Cl2↑,F电极反应式2H2O+2e-=H2↑+2OH-,此电路是串联电路,通过电量相等,因此单质物质的量之比为1:2:2:2;(3)电镀时,待镀金属作阴极,镀层金属作阳极,铜件作阴极,银单质为阳极,因此H是铜,电镀液含有Ag+,电镀液是AgNO3;(4)活动性金属作阳极,金属先失电子,即Fe-2e-=Fe2+,阴极:Cu2++2e-=Cu,总电极反应式为Fe+Cu2+=Fe2++Cu。

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案